1、选择题 下列叙述中正确的是
A.体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,分别稀释m倍、n倍,溶液的pH都变成9,则m<n
B.有甲、乙两醋酸溶液,测得甲的pH=a,乙的pH=a+1,若用于中和等物质的量浓度等体积的NaOH溶液,需甲、乙两酸的体积V(乙)>10V(甲)
C.25℃,pH=9的NaOH溶液和NaAc溶液中,由水电离出的c(H+)均为10-5mol·L-1
D.c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)该式满足NaHCO3溶液中的离子浓度关系。
参考答案:BD
本题解析:A:体积相同、浓度均为0.1mol/L的NaOH溶液、氨水,由于前者全部电离、后者部分电离,前者的pH大于后者,而在稀释过程,两者的pH均减小,但由于弱碱氨水中存在电离平衡,可补充部分OH—,导致氨水溶液的pH降低速率相对较小,故无法确定两溶液pH均为9时两者稀释的倍数大小
B:设甲、乙两醋酸溶液的电离度分别为α甲、α乙,由于前者酸性强,浓度较大,α甲相对较小;根据c(H+)=cα可知,c甲= ,c乙=
,c乙=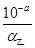 ;
;
依题意可知,两溶液所含有溶质的物质的量相等,即: V甲=
V甲=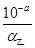 V乙,推得
V乙,推得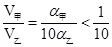 ,即V(乙)>10V(甲),正确
,即V(乙)>10V(甲),正确
C:NaOH溶液和NaAc溶液,前者OH—抑制了水的电离:H2O H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
H++OH-,而后者弱离子水解促进水的电离,故两溶液中水电离出的c(H+)一定不相等,排除
D:符合电荷守恒,正确
答案为BD
本题难度:一般
2、选择题 能使Na2CO3溶液中c(Na+)与c(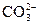 )之比更接近2∶1的措施是()
)之比更接近2∶1的措施是()
A.加水
B.加NaOH固体
C.加KOH固体
D.加热
参考答案:C
本题解析:Na2CO3溶于水,电离出Na+和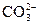 ,由于溶液中存在着下列平衡:
,由于溶液中存在着下列平衡: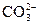 +H2O
+H2O
 +OH-,
+OH-, +H2O
+H2O H2CO3+OH-,使c(Na+)与c(
H2CO3+OH-,使c(Na+)与c(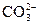 )之比大于2∶1。加水或加热都会使上述平衡向右移动,从而导致c(Na+)与c(
)之比大于2∶1。加水或加热都会使上述平衡向右移动,从而导致c(Na+)与c(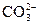 )之比变大。加入OH-可使上述平衡向左移动,c(
)之比变大。加入OH-可使上述平衡向左移动,c(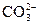 )增大。但加入NaOH使?c(Na+)增大幅度超过c(
)增大。但加入NaOH使?c(Na+)增大幅度超过c(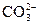 );反而使c(Na+)与c(
);反而使c(Na+)与c(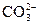 )之比变大。
)之比变大。
本题难度:简单
3、选择题 下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO3-)>c(SO32-)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的NaHA溶液pH=1,则有:c(Na+)=c(H2A)+c(HA-)+c(A2-)
参考答案:C
本题解析:A项,亚硫酸氢根离子电离生成氢离子和亚硫酸根离子,水存在微弱的电离生成氢离子和氢氧根离子,所以氢离子浓度大于亚硫酸根离子浓度,A错;B项,相同浓度的CH3COONa和Na2CO3溶液,CH3COO-的水解程度小于CO32-的水解程度,所以pH相同的CH3COONa和Na2CO3溶液:c(CH3COONa)>c(Na2CO3);C项,根据电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),由于溶液呈中性,则c(H+)=c(OH-),所以c(M+)=c(A-);D项,0.1 mol·L-1的NaHA溶液pH=1,则NaHA=Na++H++A2-,所以溶液中不存在HA-和H2A。
本题难度:一般
4、选择题 对滴有酚酞试液的下列溶液,操作后溶液颜色变深的是( )
A.明矾溶液加热
B.小苏打溶液中加入少量NaCl固体
C.氨水中加入少量NH4Cl固体
D.CH3COONa溶液加热
参考答案:A.明矾溶液中电离后产生的Al3+水解使溶液呈酸性,加热导致水解程度增大,但酚酞遇酸性溶液颜色不变化,故A错误;
B.加入少量NaCl固体不影响小苏打的电离和水解,酚酞溶液不变深,故B错误.
C.氨水为弱碱,部分电离:NH3?H2O?NH4++OH-,加入酚酞后溶液变为红色,而NH4Cl=NH4++Cl-,其中的NH4+会抑制氨水的电离,使溶液碱性减弱,颜色变浅,故C错误;
D.CH3COONa为强碱弱酸盐,水解呈碱性,滴加酚酞后溶液显红色,加热使碱性增强,因此红色变深,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 为了使0.1 mol·L-1 Na2CO3溶液中c( )接近0.1 mol·L-1,应采取(? )
)接近0.1 mol·L-1,应采取(? )
A.加水
B.通入CO2
C.加入少量盐酸
D.加入少量固体NaOH
参考答案:D
本题解析:采取的方法是抑制 的水解。
的水解。
本题难度:简单