1、选择题 0.1molMg分别在足量的O2、CO2、N2中燃烧,生成的固体质量依次为W1、W2、W3,则下列关系式中正确的是
A.W2>W1>W3
B.W1=W2>W3
C.W1=W2=W3
D.W3>W2>W1
参考答案:A
本题解析:分析:根据相同质量的Mg生成MgO和Mg3N2固体的质量增重大小,分析解答.
解答:根据关系式Mg~MgO可知,0.1molMg生成MgO,增重为:0.1mol×16g/mol=1.6g,
根据关系式3Mg~Mg3N2?可知,0.1molMg生成Mg3N2,增重为:0.1mol×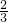 ×14g/mol=
×14g/mol=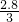 g≈0.93g.
g≈0.93g.
相同质量的Mg生成MgO比生成Mg3N2固体增重多,Mg与CO2反应,除生成等量的MgO,还有固体碳,所以W2>W1>W3.
故选A
点评:以镁的性质为载体考查学生计算能力,注意综合分析优化解题方法,易错点是镁与CO2反应易忽略生成的碳.
本题难度:简单
2、选择题 对下列实验过程的评价,正确的是
A.某固体中加入稀盐酸,产生了无色气体,证明该固体中一定含有碳酸盐
B.某溶液中滴加BaCl2溶液,生成白色沉淀.证明一定含有SO42-
C.某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+
D.验证某溶液中是否含Cl-,先加过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl-
参考答案:D
本题解析:分析:A、碳酸根离子、碳酸氢根离子可以和强酸反应生成二氧化碳气体;
B、氯化银和硫酸钡均是白色沉淀;
C、酸遇酚酞不变色,碱遇酚酞显红色;
D、根据氯离子的特征离子反应来检验氯离子.
解答:A、某固体中加入稀盐酸,产生了无色气体,证明该固体中可能含有碳酸根离子、碳酸氢根离子等离子,故A错误;
B、某溶液中滴加BaCl2溶液,生成白色沉淀,该沉淀可以是氯化银和硫酸钡(碳酸钡),证明溶液中含有银离子、硫酸根离子或是碳酸根中的至少一种离子,故B错误;
C、某无色溶液滴入酚酞试液显红色,该溶液显碱性,一定是含有大量的OH-,故C错误;
D、检验氯离子的方法是:加过量的稀硝酸,再加入AgNO3溶液,有白色沉淀,则证明含Cl--,故D正确.
故选D.
点评:本题是一道离子鉴别题,可以举出与判断相反的事例以说明判断是错误的,这是分析所做判断正误的一种较为简便可行的方法.
本题难度:一般
3、选择题 将0.1mol下列物质置于1L水中充分搅拌后,溶液中阴离子数最多的是
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:分析:根据盐类的水解和物质的溶解度思考.
解答:对于A和D,由于KCl和MgSO4溶于水并完全电离,所以n(Cl-)=n(SO42-)=0.1mol l(水电离出的OH-可忽略);对于B,B中的Mg(OH)2在水中难溶,故溶液中n(OH-)<0.1mol;对于C,在Na2CO3溶液中,由于CO32-+H2O?HCO3-+OH-,阴离子数目会增加,即阴离子物质的量大于0.1mol.由上分析,Na2CO3溶液中的阴离子数目最多,C项正确.
故答案为C.
点评:二元酸正盐阴离子水解会使溶液中的阴离子数目增多,可以作为一个解题规律来应用.
本题难度:一般
4、选择题 下列离子方程式表达不正确的是
A.用惰性电极电解氯化钠溶液:
B.用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-+3H2O═
C.用水吸收二氧化氮:3NO2+H2O═
D.水玻璃中通入足量的CO2:═
参考答案:D
本题解析:分析:A.电解生成NaOH、H2、Cl2;
B.反应生成偏铝酸钠和水;
C.反应生成硝酸和NO;
D.反应生成硅酸和碳酸氢钠.
解答:A.电解生成NaOH、H2、Cl2,离子反应为2Cl-+2H2O 2OH-+H2↑+Cl2↑,故A正确;
2OH-+H2↑+Cl2↑,故A正确;
B.反应生成偏铝酸钠和水,离子反应为Al2O3+2OH-+3H2O═2[Al(OH)4]-,故B正确;
C.反应生成硝酸和NO,离子反应为3NO2+H2O═2H++2NO3-+NO↑,故C正确;
D.反应生成硅酸和碳酸氢钠,离子反应为SiO32-+2CO2+2H2O═H2SiO3↓+2HCO3-,故D错误;
故选D.
点评:本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,并注意离子反应的书写方法,选项D为易错点,题目难度不大.
本题难度:一般
5、选择题 下列各组离子,无色透明且能大量共存的是
A.Cl-、K+、Fe3+、NO3-
B.CO32-、Na+、Cl-、K+
C.Fe2+、NO3-、Mg2+、OH-
D.SO42-、Ag+、NH4+、Cl-
参考答案:B
本题解析:分析:离子之间不能结合生成沉淀、气体、水等,离子能够大量共存,并注意常见离子的颜色来解答.
解答:A、该组离子之间不反应,能共存,但Fe3+在水溶液中为黄色,不符合题意,故A错误;
B、该组离子之间不反应,能共存,且均为无色,符合题意,故B正确;
C、Fe2+、Mg2+、能分别与OH-结合生成沉淀,则不能大量共存,且Fe2+在水溶液中为浅绿色,不符合题意,故C错误;
D、Ag+、Cl-能结合生成沉淀,则不能大量共存,故D错误;
故选B.
点评:本题考查离子的共存,明确信息中无色溶液及复分解反应发生的条件是解答本题的关键,难度不大.
本题难度:困难