1、选择题 常温时,下列各溶液中,微粒的物质的量浓度关系正确的是
A.pH = 5的NaHSO3溶液:[HSO3-]>[H2SO3]>[SO32-]
B.pH = 8的苯酚与苯酚钠混合溶液:[Na+]>[C6H5O-]>[OH-]>[H+]
C.pH = 7的CH3COONa与CH3COOH的混合溶液:[Na+]=[CH3COO-]+[CH3COOH]
D.0.1 mol/L NaHCO3溶液:[OH-] + [CO32-]= [H+]+[H2CO3]
参考答案:BD
本题解析:A中显酸性,说明电离大于水解,故NaHSO3溶液:[HSO3-]>[SO32-]>[H2SO3],错误;C中根据物料守恒判断可知错误;
本题难度:一般
2、选择题 下列实际问题,不涉及到盐类水解原理的是(?)
A.草木灰不宜与铵盐氮肥混合施用
B.用醋酸清洗保温瓶里的水垢
C.配置FeCl3溶液时加入适量的盐酸
D.用热的纯碱溶液洗涤油污效果较好
参考答案:B
本题解析:A.草木灰中碳酸根离子与铵盐中铵根离子均能水解,混合使用,会导致肥效降低。
B.醋酸清洗保温瓶里的水垢,利用的是强酸制弱酸,并没有涉及盐类水解原理。
C.配置FeCl3溶液时加入适量的盐酸,是为了抑制三价铁离子的水解。
D.用热的纯碱溶液洗涤油污效果较好,利用的是温度高时,碳酸根离子水解程度大,碱性强。
故选B
本题难度:一般
3、选择题 向1L 0.3mol/L的NaOH溶液中通入标准状况下CO2 4.48L,下列关系不正确的是
A.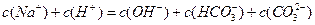
B.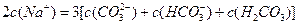
C.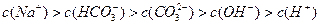
D.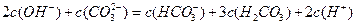
参考答案:A
本题解析:略
本题难度:一般
4、填空题 (6分)25℃时,现有浓度均为0.10 mol/L的两种溶液:① (NH4)2SO4溶液、② Na2SO4溶液。请回答:
(1)两种溶液中,pH<7的是?(填“①”或“②”),其原因是?(用离子方程式表示)。
(2)下列说法正确的是?(填序号)。
① (NH4) 2SO4是弱电解质
② (NH4) 2SO4和Na2SO4均能促进水的电离
③两种溶液等体积混合后,溶液中离子浓度大小关系为:c(Na+)= c(SO42-)>c(NH4+)>c(H+)>c(OH-)
参考答案:(6分)(1)?①? + H2O
+ H2O NH3·H2O + H+?(2)?③
NH3·H2O + H+?(2)?③
本题解析:(1)硫酸钠是不水解的,溶液显中性。而硫酸铵是强酸弱碱盐,NH4+水解,溶液显酸性。
(2)硫酸铵在溶液中是完全电离的,属于强电解质,①不正确;硫酸钠不水解,不能促进水的电离,②不正确,所以正确的答案选③。
点评:盐类水解的规律是:有弱才水解、无弱不水解、越弱越水解、都弱都水解、谁强显谁性。
本题难度:一般
5、选择题 下列过程或现象与盐类水解无关的是
A.向Na2CO3溶液中滴加酚酞试液变红色
B.实验室保存硫酸亚铁溶液时加入少量铁粉
C.加热FeCl3溶液颜色会变深
D.KAl(SO4)2·12 H2O可用于净水
参考答案:B
本题解析:A.Na2CO3+ H2O NaOH+NaHCO3。水解产生了NaOH使溶液显碱性,所以滴加酚酞试液变红色。不符合题意。错误。B.硫酸亚铁在空气中容易被氧化为Fe3+,实验室保存硫酸亚铁溶液时加入少量铁粉加入Fe粉是为了2Fe3++Fe=3Fe2+,为了防止硫酸亚铁溶液变质。这与盐的水解无关。符合题意。正确。C.FeCl3是强酸弱碱盐,盐的水解反应是酸碱中和反应的逆反应,酸碱中和反应是放热反应,所以盐的水解反应是吸热反应。升高温度促进盐的水解。所以加热FeCl3溶液会使更多的Fe3+发生水解反应得到氢氧化铁胶体,因此颜色会变深。不符合题意。错误。D.KAl(SO4)2·12 H2O电离产生的Al3+发生水解反应:Al3++3H2O
NaOH+NaHCO3。水解产生了NaOH使溶液显碱性,所以滴加酚酞试液变红色。不符合题意。错误。B.硫酸亚铁在空气中容易被氧化为Fe3+,实验室保存硫酸亚铁溶液时加入少量铁粉加入Fe粉是为了2Fe3++Fe=3Fe2+,为了防止硫酸亚铁溶液变质。这与盐的水解无关。符合题意。正确。C.FeCl3是强酸弱碱盐,盐的水解反应是酸碱中和反应的逆反应,酸碱中和反应是放热反应,所以盐的水解反应是吸热反应。升高温度促进盐的水解。所以加热FeCl3溶液会使更多的Fe3+发生水解反应得到氢氧化铁胶体,因此颜色会变深。不符合题意。错误。D.KAl(SO4)2·12 H2O电离产生的Al3+发生水解反应:Al3++3H2O Al(OH)3(胶体)+3H+.Al(OH)3胶体表面积大,吸附力强,能够吸附水中的悬浮物使之变为沉淀除去,所以可用于净水。不符合题意。错误。
Al(OH)3(胶体)+3H+.Al(OH)3胶体表面积大,吸附力强,能够吸附水中的悬浮物使之变为沉淀除去,所以可用于净水。不符合题意。错误。
本题难度:一般