1、选择题 欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )
A.通入CO2
B.加入NaOH固体
C.通入HCl
D.加入饱和石灰水溶液
参考答案:D
本题解析:在NaHCO3溶液中存在如下平衡: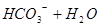 ?
?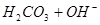 ,
,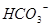 ?
?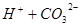 所以,A错,通入CO2气体溶液中碳酸浓度增大,平衡左移,c(H+)、c(CO32-)、c(HCO3-)都增多;B错,加入NaOH固体,能与氢离子反应,平衡右移,c(H+)减少,c(CO32-)增多,c(HCO3-)减少;C错,能入HCL,溶液中氢离子浓度增多,c(CO32-)、c(HCO3-)都减小;D正确;
所以,A错,通入CO2气体溶液中碳酸浓度增大,平衡左移,c(H+)、c(CO32-)、c(HCO3-)都增多;B错,加入NaOH固体,能与氢离子反应,平衡右移,c(H+)减少,c(CO32-)增多,c(HCO3-)减少;C错,能入HCL,溶液中氢离子浓度增多,c(CO32-)、c(HCO3-)都减小;D正确;
本题难度:一般
2、选择题 下列说法正确的是?
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO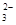 )之比为2:1
)之比为2:1
C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0
参考答案:A
本题解析:考查溶液的酸碱、pH的概念
A.正确
B.由于CO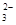 部分水解,所以溶液中c(Na+)与c(CO
部分水解,所以溶液中c(Na+)与c(CO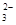 )之比大于2:1
)之比大于2:1
C.稀释弱电解质,促进其电离,故0.2 mol/L与0.1 mol/L醋酸中c(H+)之比小于2:1
D.可看出两溶液恰好反应,得到硫酸钡沉淀(其实是它的饱和溶液),其中的C(SO42-)不可能为零,只不过是非常小而已!
答案为A
本题难度:一般
3、填空题 (10分)现有电解质溶液:①Na2CO3?②NaHCO3
③NaAlO2?④CH3COONa?⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。
参考答案:(1)④>②>①>③>⑤?(2)⑤?(3)③④⑤?(4)
A +H2O+
+H2O+ ====Al(OH)3↓+
====Al(OH)3↓+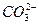
本题解析:由于盐溶液的碱性强弱取决于阴离子的水解能力,故当pH相同时,越难水解的盐,浓度越大;前四种都是能水解的盐溶液,其中都存在着水解平衡,当稀释时,由于平衡的移动,溶液的酸碱性变化会得以缓冲,变化的幅度会减少,而NaOH溶液中的n(OH-)基本不变,在体积增大时c(OH-)的变化幅度会是最大的,其pH变化也最大;①和②由于盐水解的相互促进,都与Al3+作用产生CO2气体,后三种溶液没有提供产生气体的离子,所以都不会有气体产生;四种溶液混合能否发生离子反应,主要看阴离子间能否相互作用,只有AlO2-和 可以反应。
可以反应。
本题难度:简单
4、选择题 弱酸酸式盐的酸根离子电离和水解并存,已知HSO3—电离大于水解。以NaHXO3表示NaHCO3和NaHSO3。对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是(?)
A.c(Na+)+c(H+)=c(OH—)+c(HXO3—)+2c(XO32—)
B.c(Na+)= c(HXO3—)+ c(H2XO3)+c(XO32—)
C.c(Na+)> c(HXO3—)>c(H+)>c(OH—)
D.c(OH—)= c(H+)+ c(H2XO3)—c(XO32—)
参考答案:C
本题解析:C项:NaHSO3溶液呈酸性,说明溶液中HSO3-电离程度大于水解程度,c(H+)>>c(OH-),NaHCO3溶液呈碱性,说明HCO3-水解沉淀大于电离程度,c(OH-)>c(H+),故C错误。故选C。
点评:本题考查离子浓度的大小比较,题目难度较大,解答本题时注意从守恒的角度分析,本题中还要注意题目要求,即浓度均为浓度均为0.1mol?L-1的NaHSO3溶液和NaHCO3溶液中均存在的关系,此为解答该题的关键之处,注意审题。
本题难度:一般
5、填空题 (9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显?(填“酸性”、“中性”或“碱性”)。理由是
___________________________________________(用离子方程式表示)
(2)在0.1 mol/L的Na2A溶液中,下列离子浓度关系不正确的是?。
A.c(A2-)+c(HA-)=0.1 mol/L
B.c(H+)=c(OH-)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)