1、选择题 欲使0.1 mol·L-1的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减小,其方法是( )
A.通入CO2
B.加入NaOH固体
C.通入HCl
D.加入饱和石灰水溶液
2、选择题 下列说法正确的是?
A.pH=2和pH=1的硝酸中c(H+)之比为1:10
B.Na2CO3溶液c(Na+)与c(CO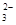 )之比为2:1
)之比为2:1
C.0.2 mol/L与0.1 mol/L醋酸中c(H+)之比为2:1
D.pH=1的硫酸中加入等体积0.05 mol/L的BaCl2溶液,两者恰好反应C(SO42-)=0
3、填空题 (10分)现有电解质溶液:①Na2CO3?②NaHCO3
③NaAlO2?④CH3COONa?⑤NaOH。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是__________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,pH变化最大的是__________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是__________(填编号)。
(4)将上述①②③④四种电解质溶液混合,发生反应的离子方程式为__________。
4、选择题 弱酸酸式盐的酸根离子电离和水解并存,已知HSO3—电离大于水解。以NaHXO3表示NaHCO3和NaHSO3。对于NaHCO3和NaHSO3溶液,下列关系式中不正确的是(?)
A.c(Na+)+c(H+)=c(OH—)+c(HXO3—)+2c(XO32—)
B.c(Na+)= c(HXO3—)+ c(H2XO3)+c(XO32—)
C.c(Na+)> c(HXO3—)>c(H+)>c(OH—)
D.c(OH—)= c(H+)+ c(H2XO3)—c(XO32—)
5、填空题 (9分)某二元酸H2A在水中的电离方程式:H2A==H++HA-;HA- H++A2-
H++A2-
试完成下列问题:
(1)Na2A溶液显?(填“酸性”、“中性”或“碱性”)。理由是
___________________________________________(用离子方程式表示)
(2)在0.1 mol/L的Na2A溶液中,下列离子浓度关系不正确的是?。
A.c(A2-)+c(HA-)=0.1 mol/L
B.c(H+)=c(OH-)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)