1、选择题 设C(S)+CO2(g) 2CO(g) △H>0,反应速率为u1,N2(g)+3H2(g)
2CO(g) △H>0,反应速率为u1,N2(g)+3H2(g) 2NH3(g) △H<0反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为(?)
2NH3(g) △H<0反应速率为u2,对于上述反应,当温度升高时,u1和u2的变化情况为(?)
A.同时增大
B.同时减小
C.增大,减小
D.减小,增大
2、选择题 少量铁粉与100 mL 0.01 mol/L的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变产生H2的量,可以使用如下方法中的(?)
①加H2O?②加NaOH固体?③滴入几滴浓盐酸?④加CH3COONa固体?⑤加NaCl溶液
⑥滴加几滴硫酸铜溶液 ⑦升高温度(不考虑盐酸挥发)⑧改用10 mL 0.1 mol/L的盐酸
A.①⑥⑦
B.③⑤⑧
C.③⑦⑧
D.③⑥⑦⑧
3、选择题 下列各组Na2S2O3溶液跟稀H2SO4反应的实验中,溶液中最先变浑浊的是
选项
| 反应
温度
| 反?应?物
| H2O
|
Na2S2O3
| H2SO4
|
t(℃)
| V(mL)
| c(mol×L-1)
| V(mL)
| c(mol×L-1)
| V(mL)
|
A
| 10
| 5
| 0.1
| 10
| 0.1
| 10
|
B
| 10
| 5
| 0.1
| 5
| 0.1
| 30
|
C
| 30
| 5
| 0.1
| 5
| 0.1
| 10
|
D
| 30
| 5
| 0.2
| 5
| 0.2
| 35
|
?
4、实验题 某课外兴趣小组对H2O2的分解速率做了如下实验探究。
(1)下表是该小组研究影响过氧化氢(H2O2)分解速率的因素时采集的一组数据:用10mL H2O2制取
150mLO2所需的时间(秒)
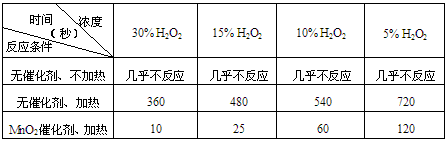
①该研究小组在设计方案时。考虑了浓度、_________、_________等因素对过氧化氢分解速率的影响。
②从上述影响过氧化氢分解速率的因素中任选一个,说明该因素对分解速率有何影响_____________。
(2)将质量相同但聚集状态不同的MnO2分别加入到5mL 5%的双氧水中,并用带火星的木条测试。测定结果如下

①写出H2O2发生的化学反应方程式_______________________。
②实验结果说明催化剂作用的大小与_____________有关。
5、填空题 请仔细观察两种电池的构造示意图
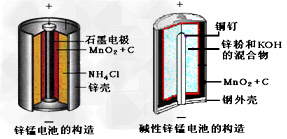
回答下列问题:
(1)碱性锌锰电池的总反应式:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,则负极的电极反应式:__________________
(2)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。试从影响反应速率的因素分析其原因是____________________
(3)某工厂回收废旧锌锰电池,其工艺流程如下
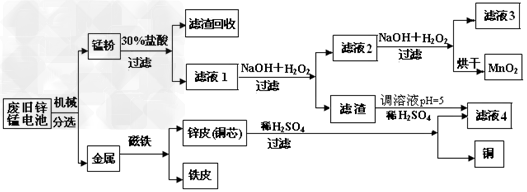
已知:生成氢氧化物的pH如下表

①经测定,“锰粉”中除含少量铁盐和亚铁盐外,主要成分应是MnO2、Zn(OH)2、__________。
②第一次加入H2O2后,调节pH=8.0。目的是_______________。
③试列举滤液4的应用实例____________________。