1、简答题 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
(1)配平下列第②个反应,将系数填在横线上.
①NaIO3不足时,发生反应:2NaIO3+6NaHSO3=2NaI+3Na2SO4+3H2SO4
②NaIO3足量时,发生反应:______NaIO3+______NaHSO3=______I2+______Na2SO4+______H2SO4+______H2O
(2)现模拟工业制取I2.在含5molNaHSO3的溶液中逐滴加入NaIO3溶液.请画出加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线.
(3)若工业上要生产2.54吨I2,至少需要处理标准状况下SO2的体积分数为0.224%的硫酸厂的尾气多少立方米?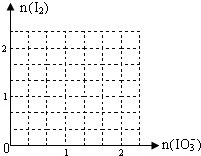
2、填空题 实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4二主要流程如下:

⑴制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式?。
⑵如图所示,过滤操作中的一处错误是?。判断流程中沉淀是否洗净所用的试剂是?。高温焙烧时,用于盛放固体的仪器名称是?。

⑶在25℃下,向浓度均为0.01 mol?L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成_______沉淀(填化学式),生成该沉淀的离子方程式_______?______________
(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10 -34。)
⑷无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。

装置B中盛放饱和NaCl溶液,该装置的主要作用是?; F中试剂的作用是?;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为?。
⑸将Mg、Cu组成的3.92g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体1.792L(标准状况),向反应后的溶液中加入4mol/L的NaOH溶液80mL时金属离子恰好完全沉淀。则形成沉淀的质量为?g。
3、填空题 A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的液态化合物。 请回答下列问题:
(1)B的原子结构示意图?。
(2)C、D、E三种原子对应的离子半径由大到小的顺序是??(填具体离子);由A、B、C三种元素按4∶2∶3组成的化合物所含的化学键类型为?。
(3)用某种废弃的金属易拉罐与A、C、D组成的化合物溶液反应,该反应的离子方程式为:?。
(4)在100 mL 18 mol/L的浓的A、C、E组成的酸溶液中加入过量的铜片,加热使之充分反应, 产生的气体在标准状况下的体积可能是?(填序号);
a.7.32 L? b.6.72 L? c.20.16 L? d.30.24 L
若使上述反应中剩余的铜片继续溶解,可向其中加入硝酸钠,反应的离子方程式为:?。
(5)A、C两元素的单质与熔融K2CO3组成的燃料电池,其负极反应式为?,用该电池电解1 L 1 mol/L NaCl溶液当消耗标准状况下1.12 L H2时,NaCl溶液的pH=??(假设电解过程中溶液的体积不变)。
4、选择题 a mol FeS与b mol FeO投入到V L、c mol·L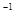 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63 g?②(a+b)×189 g
③(a+b) mol?④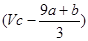 mol
mol
A.①④
B.②③
C.①③
D.②④
5、选择题 将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140 mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的物质的量浓度是
A.5 mol/L
B.7 mol/L
C.10 mol/L
D.12 mol/L