|
高中化学知识点讲解《未知》考点特训(2020年冲刺版)(八)
2021-06-11 06:53:19
【 大 中 小】
|
1、选择题 下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2O
B.CaO+H2O=Ca(OH)2
C.2CO+O2
D.CaCO3
|
参考答案:C
本题解析:略
本题难度:一般
2、计算题 取含MnO2的软锰矿石27.86g,跟足量浓盐酸反应,制得5.6L氯气(该状态下Cl2密度为3.17g/L)计算:
(1)这种软锰矿石中MnO2的质量分数?
(2)被氧化的HCl为多少g?
参考答案:(1)78.1%? (2)18.25
本题解析:解:(1)设该27.86g含有的MnO2的质量为x,被氧化的HCl的质量为y,根据
MnO2?+? 4HCl(浓)? =? MnCl2?+? Cl2↑
87? 146? 71
x? y? 3.17×5.6=17.752g?
即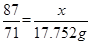 ?,解得 ?,解得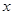 =21.752, =21.752,
所以这种软锰矿石中MnO2的质量分数=21.752/27.86×100%="78.1%" ;
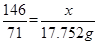 ?解得y=36.50g,即参加反应的HCl为36.50g, ?解得y=36.50g,即参加反应的HCl为36.50g,
即被氧化的HCl=1/2×36.50=18.25g。
点评:本题考查了化学反应方程式的简单计算,该题难度适中,但是要注意5.6L的氯气并不是在标准状况下的。
本题难度:一般
3、选择题 a mol FeS与b mol Fe3O4投入到V L c mol·L-1的硝酸溶液中恰好完全反应,假设只产生NO气体。所得澄清溶液的成分是Fe(NO3)3和H2SO4的混合液,则反应中未被还原的硝酸为( )
A.(a+3b) mol
B.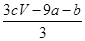 mol mol
C.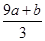 mol mol
D.(cV-3a-9b) mol
参考答案:B
本题解析:设NO的物质的量为x,根据电子守恒得:
3x=a+8a+b=9a+b,
所以混合溶液中,未被还原的HNO3的物质的量为cV-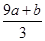 = =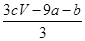 ?mol。 ?mol。
本题难度:一般
4、填空题 (本题共12分)元素周期表中ⅦA族元素的单质及其化合物的用途广泛。
23.与氯元素同族的短周期元素的原子,其核外能量最高的电子所处的电子亚层是 ;
24.碘元素在元素周期表中的位置是 ;为防缺碘,食盐中常添加碘酸钾,该物质内存在 键(填化学键类型)。
25.溴单质是唯一常温下呈液态的非金属单质,它的电子式是 ;液溴的保存通常采取的方法是 。
26.通过比较___________或________________可以判断氯、溴两种元素非金属性强弱。
27.工业上,通过如下转化可制得KClO3晶体:
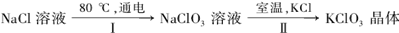
①配平I中反应的总化学方程式,并标出电子转移的方向和数目:
□NaCl + □H2O  □NaClO3+ □ □NaClO3+ □
②II反应过程能析出KClO3晶体而无其它晶体析出的原因是 。
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是_________________________。
参考答案:23.2p (1分) 24.第五周期ⅦA族(1分) 离子键、共价键(1分)
25.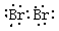 (1分) 水封在棕色瓶中,密闭保存(1分) (1分) 水封在棕色瓶中,密闭保存(1分)
26.HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性 (2分)(合理即可)
27.①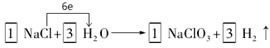 (H2 、系数1分,方向数目1分) (H2 、系数1分,方向数目1分)
②室温下,氯酸钾在水中的溶解度明显小于其它晶体(1分)
28.4CuCl(s) + O2(g)=2CuCl2(s) + 2CuO(s)ΔH=—177.6kJ/mol (2分)
本题解析:23.与氯元素同族的短周期元素F元素的原子核外有9个电子,其核外电子排布式是1s22s22p5。可见其能量最高的电子所处的电子亚层是2p亚层;
24.53号元素碘元素核外有5个电子层,最外层有7个电子,所以在元素周期表中的位置是第五周期ⅦA族;为防缺碘,食盐中常添加碘酸钾,该物质是离子化合物,内存在离子键、极性共价键;
25.溴单质是唯一常温下呈液态的非金属单质,它是双原子分子,两个原子共用一对电子,都达到8个电子的稳定结构。它的电子式是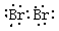 ;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。 ;液溴容易挥发,由于其密度比水大,在水中溶解度不大,所以液溴通常保存采取在棕色瓶内,并加水形成水封,密封保存。
26.元素的非金属性越强,其相应的氢化物的稳定性就越强。最高价的含氧酸的酸性也越强。所以可以通过比较HCl和HBr的气态氢化物的热稳定性、HClO4和HBrO4的酸性可以判断氯、溴两种元素非金属性强弱。
27.①由于在反应中Cl元素的化合价升高,则根据氧化还原反应的规律,还应该有元素的化合价降低,只有H元素符号该性质,得到电子变为H2,结合电子守恒及原子守恒可得方程式为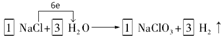
②II反应过程能析出KClO3晶体而无其它晶体析出是因为室温下,氯酸钾在水中的溶解度明显小于其它晶体
28.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应消耗1 mol CuCl(s),放热44.4 kJ,根据题意可得该反应的热化学方程式是4CuCl(s) + O2(g) = 2CuCl2(s) + 2CuO(s) ΔH=—177.6kJ/mol。
考点:考查原子核外电子的排布、物质内的化学键的类型的判断、物质电子式的书写、物质的保存、元素非金属性强弱比较、氧化还原反应方程式的配平及热化学方程式的书写的知识。
本题难度:困难
5、简答题 现有短周期元素组成的A、B、C、D、E五种物质,存在如下转化关系(部分产物已略去),其中E为黑色粉末,D为无色气体.
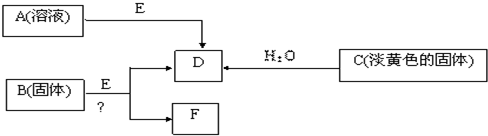
(1)若B为含氯元素的钾盐,与浓盐酸反应可以生成黄绿色气体,且1mol?B转移5mol?电子,则B与浓盐酸反应的化学方程式为______.?生成的氧化产物与还原产物的物质的量之比为______;
(2)将F从混合物中分离出来的实验操作步骤为______、______、______.由A制得2mol?D时,转移电子数为______?mol
(3)电解F的饱和水溶液得到碱溶液M,写出该反应的离子方程式;______,若将浓度为?c?mol?L-1?的M溶液与0.2mol?L-1?的一元酸HA等体积混合,所得溶液pH=7.溶液中离子浓度的大小关系为______?(浓度用C表示).
(4)固体C与FeCl3溶液按物质的量为2:1反应的离子方程式______;
将Fe(OH)3和NaOH与NaClO混合作用后,是制得緑色水处理剂(Na2FeO4)的一种方法,请完成下列方程式:
______Fe(OH)3+______NaOH+______NaClO=______Na2FeO4+______NaCl+______H2O.
参考答案:短周期元素组成的A、B、C、D、E五种物质,C是淡黄色固体,与水反应生成无色气体D,故C为Na2O2,D为O2,E为黑色粉末,由A溶液E
本题解析:
本题难度:一般
|