1、选择题 将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有?(?)
A.Cu、Fe3+
B.Fe2+、Fe3+
C.Cu、Cu2+、Fe
D.Cu、Fe2+、Fe
参考答案:D
本题解析:由于铁离子、铜离子都能氧化单质铁,所以如果铁有剩余,则溶液中就一定不能再存在铁离子、铜离子,只能是亚铁离子,所以答案选D。
点评:该题是中等难度的试题,试题基础性强,难易适中。该题的关键是熟练记住铁单质的化学性质,然后结合题意灵活分析、判断即可。有助于培养学生的应试能力,提高学生的学习效率。
本题难度:一般
2、选择题 为了将FeCl2溶液转化成FeCl3溶液,最好的方法是向此溶液中
A.通入氯气
B.加入HCl
C.加入Fe
D.加入Cu
参考答案:A
本题解析:氯气不但能氧化FeCl2,而且还生成FeCl3,不引入任何杂质粒子,答案为A
本题难度:一般
3、选择题 根据以下叙述制备氯化铜:先将浓盐酸用蒸汽加热至80 ℃左右,慢慢加入含有FeO杂质的CuO粉,充分反应,使其溶解。已知:FeS不溶于水,但溶于酸。
溶液中被沉淀离子
| Fe3+
| Fe2+
| Cu2+
|
完全生成氢氧化物沉淀时,溶液的pH
| ≥3.7
| ≥9.6
| ≥6.4
|
?
在除去溶液中的Fe2+时,可采用的方法是( )
A.可直接加碱,调整溶液的pH≥9.6
B.加入纯铜粉,将Fe2+还原为Fe
C.先将Fe2+氧化成Fe3+,再调整溶液pH至3~4
D.通入H2S使Fe2+直接沉淀
参考答案:C
本题解析:当溶液达到Fe2+沉淀所需pH时,溶液中的Cu2+已经沉淀完全,无法分离;Cu与Fe2+不反应;由已知信息中FeS溶于酸知选项D错;故应先把Fe2+氧化成Fe3+,再调节pH使之沉淀,最后分离即可。
本题难度:一般
4、简答题 铁元素及其化合物与人类的生产生活息息相关,
试回答下列问题:
(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,写出该反应的离子方程式______.
(2)高炉炼铁过程中会发生反应:FeO(s)+CO(g)?Fe(s)+CO2(g).
已知:Fe(s)+
O2(g)═FeO(s)△H=-272kJ?mol-1
C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
则:①FeO(s)+CO(g)?Fe(s)+CO2(g)△H=______.
②一定温度下,向某密闭容器中加人足量FeO,并充人一定量的CO气体,反应过程中CO和CO2的浓度与时间的关系如图所示
则从开始至达到平衡过程中,v(CO)=______;该温?度下,FeO(s)+CO(g)?Fe(s)+CO2(g)的化学平衡常数K=______.
(3)铁红是一种红色颜料,其成份是Fe2O3.将一定量的铁红溶于160mL 5mol?L-1盐酸中,再加人一定量铁粉恰好完全溶解,收集到气体2.24L(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为______.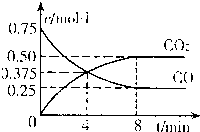
参考答案:(1)电子工业常用30%,的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为:2Fe3++Cu=2Fe2++Cu2+,故答案为:2Fe3++Cu=2Fe2++Cu2+;
(2)①a、Fe(s)+12O2(g)═FeO(s)△H=-272kJ?mol-1
b、C(s)+O2(g)═CO2(g)△H=-393.5kJ?mol-1
c、2C(s)+O2(g)═2CO(g)△H=-22lkJ?mol-1
依据盖斯定律b-c÷2-a得到:FeO(s)+CO(g)?Fe(s)+CO2(g)△H=-1lkJ?mol-1;
故答案为:一1lkJ?mol-1;
②阳极图象分析,从开始至达到平衡过程中CO的浓度变化为0.75mol/L-0.25mol/L=0.5mol/L;时间为8min,所以v=0.5mol/L8min=0.625mol?L-1?min-1;
FeO(s)+CO(g)?Fe(s)+CO2(g)平衡状态物质的浓度为:c(CO)=0.25mol/L,c(CO2)=0.5mol/L,K=c(CO2)c(CO)=0.5mol/L0.25mol/L=2;
故答案为:0.625mol?L-1?min-1;2;
(3)氢气的物质的量为 2.24L22.4L/mol=0.1mol,
Fe~~~~2HCl~~~H2,
0.1mol 0.2mol 0.1mol
根据氯原子守恒,所以氯化铁的物质的量为13×(0.16L×5mol/L-0.2mol)=0.2mol,
Fe~~~2FeCl3
0.1mol 0.2mol
所以参加反应的铁粉的质量为(0.1mol+0.1mol)×56g/mol=11.2g,
故答案为:11.2g.
本题解析:
本题难度:一般
5、实验题 (7分)某学生设计了一个制取氢氧化亚铁的实验方案,实验装置见图,请分析实验过程:
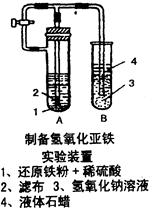
(1)在B试管中加入NaOH溶液后加热煮沸l-2分钟并立即加入2mL液体石蜡,上述操作目的是?。
(2)在具支试管A中加入稀H2SO4溶液和略微过量的铁粉,分析为什么铁粉要过量?。
(3)连接好导管,同时打开活栓,当铁粉与稀硫酸反应平稳时,关闭活栓,这时看到A试管中?(填现象),B试管中?(填现象)。
(4)如果B中产生的氢氧化亚铁遇到空气,发生变化的化学方程式为__________________? ____。
参考答案:(1)加热煮沸是为了驱除溶在NaOH溶液中的氧气( 1分),加入液体石蜡是隔绝空气,防止生成的氢氧化亚铁被空气氧化?( 1分)?
(2)保证溶液中不存在Fe3+( 1分)。?
(3)溶液经导管压入B试管中( 1分),产生白色沉淀( 1分)。
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3?( 2分)
本题解析:(1)制取氢氧化亚铁重点是隔绝氧气、防止氧化;
(2)通过反应2Fe3++Fe=3Fe2+来保证溶液为纯净的亚铁盐
(3)先用产生的氢气排除系统内的氧气,再关闭活塞,溶液由A中被压入B试管中,产生沉淀
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3?( 2分)
本题难度:一般