1、选择题 CuCO3和Cu2(OH)2 CO3的混合物34.6克,可恰好完全溶解于300ml 2 mol·L-1的盐酸中,加热分解等质量的这种混合物可得CuO的质量为?(?)
A.16克
B.19.2克
C.24克
D.30.6克
参考答案:C
本题解析:略
本题难度:简单
2、填空题 (15分)随着信息产业的高速发展和家用电器的普及,我国印刷电路板(PCB)的生产呈现急剧增长之势。废旧电路板的增多给我们带来了环境问题,目前我们台州大多采用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜,从而进行对铜的回收和利用。经分析腐蚀废液中主要含有HCl 、FeCl2和CuCl2等溶质。
(1)用32%~35%的FeCl3溶液溶解印刷线路板上的金属铜的原理是
(用离子方程式表示):? ▲?。
(2)工业上有多种回收腐蚀废液中铜的方法,下面是常用的两种方法:
Ⅰ、电化学方法回收腐蚀废液中铜,则阳极(石墨)上的电极反应式为:? ▲?。
Ⅱ、工业上也可以用铁粉回收腐蚀废液中的铜:
①用铁粉回收铜的实验操作为?▲?。
②科学家对铁置换铜工艺的研究如下:
分别用还原铁粉、废铁屑和废铁屑在超声波粉碎处理下置换铜,将置换出的铜粉放入250mL烧杯中,加入120mL 1.5 mol·L-1的硫酸,水浴加热,控制温度在70 ℃,搅拌,在10、20、30、40、50、60min时,分别用吸管移取0.5g左右的铜于试管内,将上层清液倒回小烧杯中,用蒸馏水洗净试样,过滤,在105℃烘箱中烘干后测定铜粉中铁的含量。其结果如图所示。
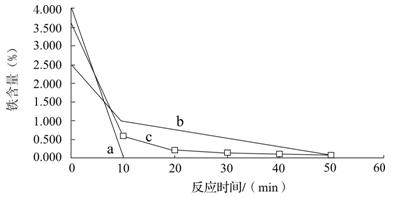
已知a表示用还原铁粉置换铜的除铁效果,b表示用废铁屑置换铜的除铁效果,c表示用废铁屑在超声波下置换铜的除铁效果,你认为除铁效果最好的是? ▲?(填a、b或c),其原因是? ▲?。
(3)工业上也可用腐蚀废液生成CuCl2·2H2O,从而进行对废液的利用,其工艺流程如下:
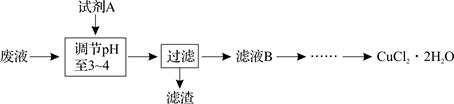
已知:pH ≥9.6时,Fe2+以Fe(OH)2的形式完全沉淀;pH ≥6.4时,Cu2+以Cu(OH)2的形式完全沉淀;pH在3~4时,Fe3+以Fe(OH)3的形式完全沉淀。
①试剂A最好应选用? ▲?。
a.浓硫酸? b.Cl2?c.NaClO d.NaOH溶液
理由是? ▲?。
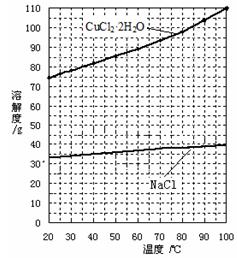
②分析有关物质的溶解度曲线(如下图),为了获得CuCl2·2H2O晶体,对滤液B进行的操作是:? ▲?、? ▲?,过滤得到产品。
③测定CuCl2·2H2O产品的质量分数可按下法:取2.000g产品,用水溶解后,加入60.00 mL 0.4000 mol·L-1的KI溶液(足量),充分反应后加入淀粉指示剂,用0.4000 mol·L-1 Na2S2O3标准溶液滴定,耗去此标准液25.00 mL时,刚好到达滴定终点。
已知:2Cu2++4I-=2CuI↓+I2? I2+2S2O32-=2I-+S4O62-
此产品中CuCl2·2H2O的质量分数为? ▲?。
参考答案:(15分)
(1) 2Fe3++Cu=2Fe2++Cu2+(1分)
(2)Ⅰ、阳极:Fe2+-e- ?Fe3+?(2分)
?Fe3+?(2分)
Ⅱ、①加入过量铁粉CuCl2 + Fe Cu + FeCl2,过滤,在所得固体中加入稀盐酸溶解残余的铁,再滤出固体洗涤得铜。(2分)②a (1分) ;使用细铁粉,还原得细铜粉,铜粉颗粒越小,与酸接触的表面积越大,内部的铁与酸反应越快,即除铁效率越高。(2分)
Cu + FeCl2,过滤,在所得固体中加入稀盐酸溶解残余的铁,再滤出固体洗涤得铜。(2分)②a (1分) ;使用细铁粉,还原得细铜粉,铜粉颗粒越小,与酸接触的表面积越大,内部的铁与酸反应越快,即除铁效率越高。(2分)
(3)①c (1分);NaClO能将Fe2+氧化为Fe3+,且反应能消耗H+,增大溶液的pH使Fe3+?沉淀(2分)
②蒸发浓缩,冷却结晶(2分)?③85.50% (2分)
本题解析:略
本题难度:简单
3、选择题 用铜锌合金制成假元宝欺骗行人事件屡有发生。下列不易区别其真伪的方法是
A.测定密度
B.放入硝酸中
C.放入盐酸中
D.观察外观
参考答案:D
本题解析:不同的物质具有不同的密度所以可以根据密度来区分铜锌合金和假元宝,A可以鉴别;铜锌合金中的铜和锌都可以与硝酸反应,产生气泡,若果是金元宝则不能反应,没有气泡产生,B可以鉴别;铜锌合金中的锌可以与盐酸反应产生气泡,C可以鉴别,铜锌合金是黄色的,金也是黄色,所以通过观察外观是不能鉴别的,答案选D。
本题难度:一般
4、填空题 铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)FeCl3溶液用作蚀刻铜箔制造电路板的工艺,离子方程式为 ?
(2)现有一含有FeCl2和FeCl3的混合样品,测得n(Fe): n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为___? _。证明混合物中存在Fe2+的操作:?,在实验室中,FeCl3可用铁粉和___?____反应制备.
(3)有学生利用FeCl3溶液制取FeCl3·6H2O晶体主要操作包括:滴入过量盐酸,?、冷却结晶、过滤。过滤中要用到的玻璃仪器有漏斗、烧杯和?。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为___?。
参考答案:(1) 2Fe3++Cu==Cu2++2Fe2+ ?
(2)10%?取少量溶液,滴入高锰酸钾溶液,若溶液褪色,则有Fe2+;? Cl2
(3)?蒸发浓缩、玻璃棒?(4)2Fe3++3ClO-+10OH-===2FeO42-+3Cl-+5H2O
本题解析:(1)氯化铁能和金属铜反应,方程式是2Fe3++Cu==Cu2++2Fe2+。
(2)设样品中FeCl2和FeCl3的物质的量分别是x和y,则(x+y)︰(2x+3y)=1︰2.1,解得x=9y,所以该样品中FeCl3的物质的量分数为1÷(1+9)=0.1,即10%;亚铁离子碱液还原性,检验方法是取少量溶液,滴入高锰酸钾溶液,若溶液褪色,则有Fe2+;铁和氯气反应即得到氯化铁。
(3)要得到氯化铁晶体,则应该是滴入过量盐酸、蒸发浓缩、冷却结晶、过滤。过滤还需要玻璃棒引流。
(4)首先写大体物质,高铁酸根被还原为Fe3+。然后再写出转移的电子数,根据电荷守衡,因为溶液是碱性的,所以产物只能写成8个OH-。一个Fe3+结合3个OH-生成Fe(OH)3,因为负极反应式为Zn - 2e- = Zn2+,所以最后一个方程式只需要综合得失电子守衡,将正、负极反应加和就可以得出正确答案。
本题难度:一般
5、填空题 (9分)FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入?溶液检验;如已氧化,可向其中加入过量?以除去其中的Fe3+,反应的离子方程式为?
参考答案:
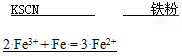
本题解析:略
本题难度:一般