| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》练习题(二)
参考答案:B 本题解析:根据质量守恒定律,化学反应前后有几个不变,其中反应前后元素种类不变,原子种类和个数都不变即电子总数不变,原子质量以及物质的总质量也不变,故①②⑤对,反应一定伴随能量的变化,故⑥错,物质种类可能存在单质和化合物之间的转化,分子总数可以发生变化,故③④错,所以B项正确。 本题难度:一般 3、选择题 NA为阿伏伽德罗常数,下列叙述错误的是 |
参考答案:D
本题解析:A.乙烯和丁烯最简式是CH2,式量是14,42g乙烯和丁烯混合气体含有最简式是3mol;所以含有的极性键数为6 NA,正确;B.Mg是+2价的金属,所以1 mol Mg与足量O2或N2反应生成MgO或Mg3N2均失去2 NA个电子,正确;C.由CO2和O2组成的混合气体中共有NA个分子,由于在每一个分子中含有2个O原子,所以1mol的混合气体中的氧原子数为2NA,正确;D.SO2与氧气生成SO3的反应是可逆反应,所以6.4g SO2与足量氧气反应生成SO3,转移电子数小于0.2 NA,错误。
考点:考查阿伏伽德罗常数的计算的知识。
本题难度:一般
4、选择题 (2013?潍坊模拟)在常压和500℃条件下,等物质的量的Ag2O、Fe(OH)3、NH4HCO3、NaHCO3完全分解,所得气体体积依次为V1、V2、V3、V4,体积大小顺序正确的是( )
A.V3>V2>V4>V1
B.V3>V4>V2>V1
C.V3>V2>V1>V4
D.V2>V3>V1>V4
参考答案:A
本题解析:写出各种物质分解的方程式,根据方程式判断.
解:各物质分解的方程式分别为:
①2Ag2O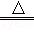 4Ag+O2↑,2mol氧化银产生1mol氧气;
4Ag+O2↑,2mol氧化银产生1mol氧气;
②2Fe(OH)3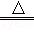 Fe2O3+3H2O↑,2mol氢氧化铁产生3mol水蒸气;
Fe2O3+3H2O↑,2mol氢氧化铁产生3mol水蒸气;
③NH4HCO3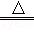 NH3↑+H2O↑+CO2↑,2mol碳酸氢铵产生6mol气体;
NH3↑+H2O↑+CO2↑,2mol碳酸氢铵产生6mol气体;
④2NaHCO3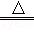 Na2CO3+CO2↑+H2O↑,2mol碳酸氢钠产生2mol气体;
Na2CO3+CO2↑+H2O↑,2mol碳酸氢钠产生2mol气体;
故各取2mol在500℃条件下加热完全分解,得到的气体体积由大到小的顺序为③>②>④>①.
故选A.
点评:本题考查化学方程式的有关计算,题目难度不大,注意有关反应的方程式的书写,氧化银的分解反应比较陌生,在金属的冶炼中涉及.
本题难度:一般
5、选择题 把300ml有BaCl2和AlCl3的混合溶液分成3等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入等体积4bmol/L氢氧化钠溶液,恰好使产生的沉淀溶解。则该混合溶液中氯离子浓度为
A.20a/3 +b
B.20a+3b
C.2a+3b
D.10a+2b
参考答案:B
本题解析:根据反应式Ba2++SO42-=BaSO4↓、Al3++4OH-=AlO2-+2H2O可知,每一份溶液中Ba2+的物质的量是amol,Al3+的物质的量是0.1bmol。所以根据溶液的电中性可知,每一份溶液中氯离子的物质的量是2amol+0.3bmol,则氯离子的浓度是(2amol+0.3bmol)÷0.1L=(20a+3b)mol/L,选项B正确,答案选B。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质组成与.. | |