| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《物质的量》练习题(四)
参考答案:B 本题解析:9.0g C2H6的物质的量为:n=m/M=9.0g÷30g/mol=0.3mol,5.6L 空气物质的量为:n=V÷22.4L/mol=5.6L÷22.4L/mol=0.25mol;3.01×1023个臭氧分子的物质的量为:n=N÷(6.02×1023)= (3.01×1023) ÷(6.02×1023)=0.5mol,通过比较得出B项的物质的量最小,故分子数最少。 本题难度:一般 2、填空题 (8分) 参考答案:(每空2分,共8分) 本题解析:考查物质的量的简单计算 本题难度:一般 3、选择题 下列说法正确的是( ) |
参考答案:AC
本题解析:A.二氧化碳的相对分子质量是44,正确;
B.“物质的量浓度”是一个整体不能简称为“量浓度”,B错误;
C.阿伏加德罗常数的单位是mol-1,C正确;
D.1 mol任何气态物质在标准状况下所占体积都是22.4 L,固体和液体不是,气体在非标准状况下也不一定是22.4 L,D错误。
选AC
本题难度:一般
4、填空题 (4分)现有m g某气体,它由四原子分子构成,它的摩尔质量为M g/mol.则:
(1)该气体的物质的量为________mol。
(2)该气体中所含的原子总数约为?个。
(3)该气体在标准状况下的体积为________L。
(4)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为________mol/L。
参考答案:(每空1分,共4分)?(1) 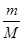 ? (2)
? (2) 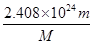 ? (3)
? (3) 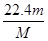 ? (4)
? (4) 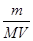
本题解析:考查物质的量的有关计算。
(1)根据n=m/M可知,该气体的物质的量为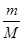 mol。
mol。
(2)该气体是由4个原子构成的,所以该气体中所含的原子总数约为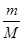 mol×4×6.02×1023/mol=
mol×4×6.02×1023/mol=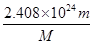 个。
个。
(3)根据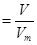 可知,该气体在标准状况下的体积为
可知,该气体在标准状况下的体积为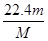 L。
L。
(4)根据c=n/V可知,该气体溶于水后形成V L溶液,其溶液的物质的量浓度为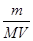 mol/L。
mol/L。
本题难度:一般
5、计算题 (6分)有一硝酸盐晶体,分子式为M(NO3)x·nH2O,经测定其摩尔质量为
242g / mol。取1.21 g此晶体溶于水,配制成100 mL溶液。将其置于电解池中用惰性材料为电极进行电解。经测定,当有0.01 mol电子通过电极时,溶液中全部金属离子即在阴极上析出,电极增重0.32 g。计算:(写出计算过程)
(1) 1.21 g此盐晶体的物质的量是多少?x值是多少?
(2) 求M的相对原子质量和n值。
参考答案:(1)0.005mol? x=2?(2)M=64g/mol? n=3
本题解析:考查根据电解原理进行的有关计算。
(1) 该盐晶体的物质的量为=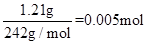
由 M-x e-=Mx+可知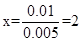 ?
?
(2) 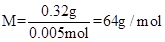
故原子量为64,即Cu。?
则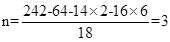
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《物质组成与.. | |