1、选择题  下列氯化物中,既能由金属和氯气直接反应制得,又可由金属和盐酸反应制得的是:
下列氯化物中,既能由金属和氯气直接反应制得,又可由金属和盐酸反应制得的是:

A.MgCl2
B.FeCl2
C.FeCl3
D.CuCl2
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (6分)实验室里通常用 MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2与浓盐酸反应制取氯气,其反应的化学方程式为:
MnO2 + 4HCl(浓) ?△??MnCl2 + Cl2↑+ 2H2O
(1)在该反应中,如有1 mol Cl2生成,被氧化的HCl的物质的量是?mol,转移电子的物质的量是?mol 。
mol Cl2生成,被氧化的HCl的物质的量是?mol,转移电子的物质的量是?mol 。
(2)某温度下,将Cl2通入NaOH溶液中,反应得到的混合液中ClO- 与ClO3- 物质的量之比为1∶1 ,反应的化学方程式是??。
参考答案:
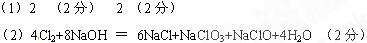
本题解析:略
本题难度:一般
3、选择题 放在敞口容器中的下列溶液,久置后溶液中溶质的浓度会变大的是()
A.浓硫酸
B.氢氧化钠
C.浓盐酸
D.氯化钠
参考答案:D
本题解析:浓H2SO4因吸水而变稀;NaOH在空气中因变质成Na2CO3导致NaOH的浓度下降;HCl易挥发而浓度下降;NaCl溶液因水分挥发而导致浓度变大。
本题难度:简单
4、简答题 学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质:
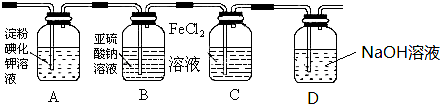
(1)通入氯气后,A中的现象是______.C装置中发生反应的离子方程式为:______.
(2)D装置的所发生反应的离子方程式______.
(3)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.在答题卡上补充填写出实验步骤、预期现象和结论.(可填满也可不填满)限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、lmol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论
步骤1:取适量洗气瓶B中溶液于试管A中,滴加______.
若产生的白色沉淀,则洗气瓶B溶液中存在SO42-.
步骤2:另取适量洗气瓶B中溶液于试管B中,滴加______.
产生白色沉淀.
步骤3:取步骤2后试管B中的上层清液于试管C中,滴加______.
______
|
(4)上述实验需要100mL,2mol/L的HCl,配制时量筒量取36.5%,密度1.19g/mL的浓盐酸的体积为______mL.
参考答案:(1)氯气有氧化性,能和碘化钾反应生成碘单质,碘遇淀粉变蓝色.能与氯化亚铁反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:溶液变蓝色,2Fe2++Cl2═2Fe3++2Cl-;
(2)氯气和氢氧化钠反应生成氯化钠和次氯酸钠,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)步骤1:除去亚硫酸根离子,可用过量2 mol/LHCl,检验硫酸根离子,可用1 mol/LBaCl2溶液,若产生的白色沉淀,则洗气瓶B溶液中存在SO42-,
故答案为:过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡;
步骤2:除去亚硫酸根离子和硫酸根离子,可用过量1 mol/LBaCl2溶液,
故答案为:过量l mol/LBa(NO3)2溶液,振荡,静置;
步骤3:检验氯离子,可用0.1mol/LAgNO3溶液和过量的2mol/LHNO3,若产生白色沉淀,则洗气瓶B溶液中存在Cl-,
故答案为:0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡;若产生白色沉淀,则洗气瓶B溶液中存在Cl-;
(4)m(HCL)=0.1L×2mol/L×36.5g/mol=1.19g/mL×v(HCL)×36.5%,v(HCL)=16.8mL,
故答案为:16.8.
本题解析:
本题难度:简单
5、填空题 铜跟氯气在点燃条件下可发生反应:Cu+Cl2=CuCl2.在该反应中,氯元素的化合价______(填“升高”或“降低”),被______(填“氧化”或“还原”,下同);Cl2作______剂,具有______性.若反应中消耗了1molCu,则生成______molCuCl2.
参考答案:该反应Cu+Cl2=CuCl2中,氯元素的化合价由0价变为-1价,所以氯元素的化合价降低,在反应中被还原,得电子化合价降低的反应物是氧化剂,氧化剂具有氧化性,根据原子守恒知,若反应中消耗了1molCu,则生成 1molCuCl2,
故答案为:降低,还原,氧化,氧化,1.
本题解析:
本题难度:简单