1、填空题 A、B、C、D、E是常见化合物或单质,有如下转化关系(略去条件和副产品).
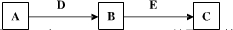
(1)若A为Na,B为NaOH,C为Na2CO3,请写出A转化为B的离子方程式______.
(2)若B为Al2O3,C为钠盐,试写出B转化为C的化学方程式______.
(3)若A为气态单质,B为漂白粉的主要成份之一,C具有漂白性.试写A转化为B的化学方程式______.画出组成单质A的元素原子结构示意图______.
(4)若A、B、C均为钠盐的水溶液,B转化为C是海水中提取溴的原理,请写出B转化为C的离子方程式______.
(5)若B、D为质子数小于18的元素原子形成的单质,且D所含元素原子的质子数是B的2倍,A转化为B,B转化为C两个反应均属置换反应,D为金属,B和C为非金属,请写出A转化为B的化学方程式______.
参考答案:(1)若A为Na,B为NaOH,C为Na2CO3,为NaH2O
本题解析:
本题难度:一般
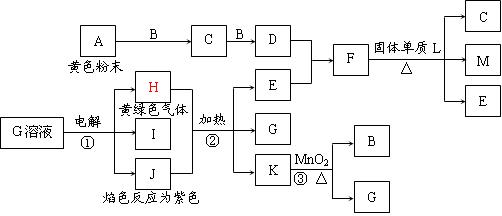
2、填空题 A是由四种短周期元素组成的正盐,X是黄绿色气体,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13,且分子中各原子处于同一直线上;D、E分子都是10电子微粒.转化关系如下(部分产物省略):
请回答下列问题:
(1)J的化学式为______,I的结构式(或电子式)为______.
(2)反应⑤的化学方程式是:______.
(3)上述转化中,属于氧化还原反应的是(填编号)______.反应④的现象______
(4)在450℃、催化剂存在下,4?mol?F和2?mol?O2反应放热353.9?kJ,此时,F的转化率为90%,则该反应的热化学方程式为:
______.
参考答案:X是黄绿色气体判断为Cl2,D、F都是无色有刺激性气味的气体;气体I对H2的相对密度是13说明I相对分子质量为26,分子中各原子处于同一直线上.证明是乙炔气体,D、E分子都是10电子微粒,判断E为H2O,Y为CaC2,H为Ca(OH)2;D气体是由H(Ca(OH)2)和G加热反应生成,判断D为NH3,G为NH4Cl,A是由四种短周期元素组成的正盐,D、F都是无色有刺激性气味的气体,F和Cl2,H2O反应,F和NH3,H2O反应,说明F是酸性气体,又是还原性气体,判断F为SO2,A为(NH4)2SO3,B为强碱,C为亚硫酸盐,J为盐酸或硫酸;
(1)依据上述推断,J为H2SO4或HCl,I的结构式为:H-C≡C-H;故答案为:H2SO4或HCl
(2)反应⑤是氯化铵和氢氧化钙加热制备氨气的 反应,反应的化学方程式是:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;
(3)上述反应中①②⑤⑥是复分解反应,③是二氧化硫被氯气氧化的氧化还原反应,④是氨气被氯气氧化的反应属于氧化还原反应;属于氧化还原反应的是:③④;反应④的反应为:氯气和氨气反应生成氮气和氯化铵固体,现象为:产生大量白烟;故答案为:③④;产生大量白烟;
(4)在450℃、催化剂存在下,4 mol F(SO2)和2 mol O2反应放热353.9 kJ,此时,F的转化率为90%,换算为2mol二氧化硫完全反应时放热多少,结合热化学方程式的书写原则写出,4molSO2,转化了4mol×90%=3.6mol,放热353.9 kJ,2molSO2全部反应放热为196.6KJ,则该反应的热化学方程式为:2SO2(g)+O2(g)催化剂.△2SO3(g)△H=-196.6?kJ?mol-1 ;
故答案为:2SO2(g)+O2(g)催化剂.△2SO3(g)△H=-196.6 kJ?mol-1
本题解析:
本题难度:简单
3、填空题 (8分)下图是中学化学中常见物质之间的相互转化关系。其中C可用于漂白,空气中M含量增加会导致温室效应。反应③常用于实验室制取气体B。
请回答下列问题:
⑴ ?C的分子式为?,J的电子式为?。
⑵ 写出反应①的离子方程式?。
⑶ 写出反应②的化学方程式?。
⑷?C、M有相似的化学性质,但也有区别,如C有漂白性、M五漂白性。?C、M具有其他不同化学性质的原因是?。
参考答案:
电解
本题解析:本题以无机的框图的形式,考查元素化合物的推导。本题的突破口有,H是黄绿色气体,应为Cl2,J焰色反应为紫色,则含K元素,对G的溶液电解,可以联想电解饱和食盐水,从而确定出G为KCl。反应③为实验室制取气体的反应,其条件为含有MnO2的加热反应,则不难得出K为KClO3,B为O2,G为KCl,由元素守恒知,反应②的产物E为水。A为淡黄色粉未,C用于漂白,由B为O2,可推断出A为S,C为SO2,D为SO3,F为H2SO4。M含量增加会导致温室效应,则为CO2气体,故L为碳。
本题难度:一般
4、填空题 已知有下图所示物质相互转换关系
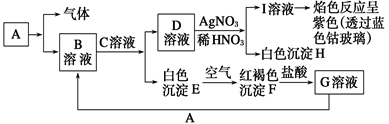
试回答:
(1)写出B的化学式?,D的化学式?。
(2) 写出由E转变成F的现象??;其发生反应的化学方程式________。
写出由E转变成F的现象??;其发生反应的化学方程式________。
(3)鉴别B溶液中阳离子的操作方法及实验现象__________________;
(4)向G溶液中加入A的离子方程式________?
参考答案:(1)FeCl2,KCl 。
。
(2 )白色沉淀迅速变灰绿色,灰绿色变成红褐色?4Fe(OH)2+O2+2H2O===4Fe(OH)3
)白色沉淀迅速变灰绿色,灰绿色变成红褐色?4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)取少量溶液,加入KSCN溶液,无现象,再加入新制氯水,出现红色,则证明含Fe2+
(4) 2Fe3+ + Fe===3Fe2+
本题解析:略
本题难度:简单
5、选择题 右图中,M、N为含X元素的常见化合物。则X元素为
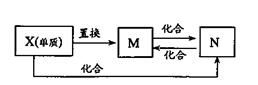
A.Fe或C
B.Cu或Fe
C.N或S
D.C或Al
参考答案:A
本题解析:略
本题难度:一般