1、选择题 一定温度下难溶电解质在水溶液中也存在沉淀溶解平衡,已知下表数据:

对含等物质的量的CuSO4、FeSO4、Fe2(SO4)3的混合溶液的说法,不科学的是
[? ]
A.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
B.该溶液中c(SO42-):[C(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该溶液中加入适量氨水,并调节pH在3~4后过滤,可获得纯净的CuSO4溶液
D.在pH=5的溶液中Fe3+不能大量存在
参考答案:C
本题解析:
本题难度:一般
2、选择题 常温下,CaSO4在水中的沉淀溶解平衡曲线如下图所示,Ksp(CaSO4)= 9.0×10-6。下列说法中正确的是

[? ]
A.通过蒸发可以使溶液由d点变到c点
B.a点对应的Ksp等于c点对应的Ksp
C.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42-)对应曲线上任意一点
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×10-3mol/L
参考答案:B
本题解析:
本题难度:一般
3、选择题 将AgCl分别加入盛有:①5 mL水;② 6 mL 0.5 mol/L NaCl溶液;③10 mL 0.2 mol/L CaCl2溶液;④50 mL 0.1 mol/L 盐酸的烧杯中,均有固体剩余,各溶液中c(Ag+)从大到小的顺序排列正确的是
[? ]
A.④③②①
B.②③④①
C.①④③②
D.①③②④
参考答案:C
本题解析:
本题难度:一般
4、选择题 在一定温度下,硫酸铜晶体的培养皿中存在下列平衡:Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s),当向饱和硫酸铜溶液中加少量无水硫酸铜粉末后,下列说法中正确的是( )
A.溶液中Cu2+浓度增大
B.溶液中Cu2+数目减少
C.该硫酸铜晶体质量不变
D.溶液的蓝色变浅
参考答案:在饱和硫酸铜溶液中加入无水硫酸铜粉末,发生:CuSO4+xH2O=CuSO4?xH2O,导致溶液中水的量减少,会导致平衡:
Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,则析出晶体后溶液仍为饱和溶液,则
A.仍为饱和溶液,则溶液中Cu2+浓度不变,故A错误;
B.Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,溶液中Cu2+数目减少,故B正确;
C.Cu2+(aq)+SO42-(aq)+xH2O?CuSO4?xH2O(s)向正方向移动,析出晶体,硫酸铜质量增大,故C错误;
D.溶液浓度不变,则溶液颜色不变,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 把Ca(0H)2放入蒸馏水中,—段时间后达到平衡: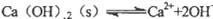
下列说法正确的是(? )。
A.向溶液中加CaO,并恢复原温度时,溶液的pH升高
B.给溶液加热,溶液的pH升高
C.向溶液中加入Na2CO3溶液,其中固体质量增加
D.向溶液中加入少量NaOH固体,Ca(0H)2固体质量不变
参考答案:C
本题解析:A、加入CaO后,平衡逆向移动,Ca(0H)2固体质量增加,但温度不变,此时溶液仍是饱和溶液,所以溶液的pH不变,错误;B、Ca(0H)2的溶解平衡为放热反应,所以升温使平衡逆向移动,氢氧根离子浓度减小,溶液的pH减小,错误;C、向溶液中加入Na2CO3溶液,钙离子浓度减小,使平衡正向移动,Ca(0H)2固体转化为CaCO3固体,固体质量增加,正确,D、向溶液中加入少量NaOH固体,氢氧根离子浓度增大,使平衡逆向移动,Ca(0H)2固体质量增加,错误,答案选C。
本题难度:简单