1、选择题 下列叙述中正确的是?(?)
A.由Cu、Zn和稀硫酸组成的原电池工作时,若Cu极生成0.2 g H2,则电路中通过0.2 mol电子
B.常温常压下,1 mol羟基(-OH)所含的电子数为10 NA
C.在标准状况下,11.2 L NO与11.2 L 02混合后气体分子数为0.75 NA
D.l mol Na202,与足量水反应,转移电子的物质的量为2 mol
参考答案:A
本题解析:略
本题难度:一般
2、选择题 设NA为阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,22.4 L甲苯中含 键数目为8 NA
键数目为8 NA
B.常温常压下,7.8 g苯中含有双键的数目为0.3 NA
C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA
D.常温常压下,5.2 g苯和苯乙烯的混合物中含有原子数目为0.8 NA
参考答案:CD
本题解析:A.标准状况下,甲苯是液体无法计算其物质的量,错误。B.常温常压下,7.8 g苯是0.1mol,但苯中不含有双键,错误。C.苯和苯甲酸的混合物1 mol,完全燃烧消耗O2的分子数为7.5 NA,正确。D.常温常压下,5.2 g苯和苯乙烯两者的最简式相同为CH,故混合物中含有原子数目为0.8 NA,正确。A为阿伏加德罗常数的运用。
本题难度:一般
3、实验题 用Na2CO3固体配制1.00 mo1·L-1的Na2CO3溶液250mL。
(1)供选用的仪器有:①玻璃棒;②胶头滴管;③100 mL量筒;④100 mL容量瓶;⑤250 mL容量瓶;⑥天平;⑦100 mL烧杯。应选用的仪器(填编号)_____________________。
(2)应称取Na2CO3的质量为________________。
参考答案:(1)①②⑤⑥⑦? (2)26.5g
本题解析:考查一定物质的量浓度溶液的配制。需要碳酸钠的质量是1.00mol/L×0.250L×106g/mol=26.5g。因为固体需要称量,溶解需要烧杯和玻璃杯,转移需要容量瓶,定容需要胶头滴管,即需要①②⑤⑥⑦。
本题难度:一般
4、填空题 12.4 g Na2X中含Na+ 0.4 mol,则Na2X的摩尔质量是____________________,X的相对原子质量是_______________。
参考答案:(4分)62g/mol? 16
本题解析:Na2X2中含Na+0.4mol,则Na2X2的物质的量为0.2mol,Na2X2的摩尔质量为12.4g/0.2mol=62g/mol,Na2X2的相对分子质量为78,则R相对原子质量为(78-23×2)/2=16,故答案为:78g/mol;16。
点评:本题考查有关物质的量的计算,明确质量、物质的量、摩尔质量的关系即可解答,难度不大。
本题难度:一般
5、选择题 阿伏加德罗常数值是NA,标准状况下,若某氧气和氮气的混合气体n g含有b个分子,则m g该混合气体在标准状况下的体积是(? )
A.22.4nb/mNA
B.22.4mb/nNA
C.22.4nNA/mb
D.nbNA/22.4m
参考答案:B
本题解析:n g氧气和氮气的混合气体的物质的量为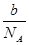 ,则可得m g该混合气体的物质的量为mb/nNA,即标准状况下的体积为22.4mb/nNA
,则可得m g该混合气体的物质的量为mb/nNA,即标准状况下的体积为22.4mb/nNA
本题难度:一般