1、实验题 (14分)实验室用密度为1.19g/mL,质量分数为36.5% 浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)配制250mL0.1mol/L的盐酸溶液
应量取盐酸体积/mL
| 应选用容量瓶的规格/mL
| 除容量瓶外还需要的其它仪器
|
|
|
|
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ________。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度2—3cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是
(4)若出现如下情况,对所配溶液浓度将有何影响(填偏高、偏低或无影响)?
没有进行A操作 ;
加蒸馏水时不慎超过了刻度 ;
定容时俯视_________________________;
未将溶液冷却就转入了容量瓶 ;
(5)若实验过程中出现如下情况如何处理?加蒸馏水时不慎超过了刻度线应 。
参考答案: (1)
应量取盐酸体积/mL
应选用容量瓶的规格/mL
除容量瓶外还需要的其它仪器
2.1ml
250ml
量筒 烧杯 玻璃棒 胶头滴管
(2)BCAFED;(3)全部转移到容量瓶;(4)偏低 偏低 偏高 偏高 (5)重新配制
本题解析: (1)(1)浓盐酸的物质的量浓度=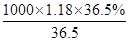 mol/L=11.8mol/L,配制250mL0.1mol?L-1的盐酸溶液,故需要250mL容量瓶,令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为除了250mL容量瓶外还有:玻璃棒、烧杯、胶头滴管、量筒;(2)所以操作步骤的顺序为BCAFED;(3)烧杯壁沾有溶质,将洗涤液都移入容量瓶,保证溶质全部转移到容量瓶内;(4)没有将洗涤液转移入容量瓶,溶质有损失,故浓度偏低,加蒸馏水超过了刻度,则溶液的体积偏大,浓度偏低,定容时俯视,溶液的体积偏小,浓度偏高,未将溶液冷却就转移,液体受热膨胀,冷却后体积偏小,浓度偏高,(5)加蒸馏水超过刻度线只能重新配制。
mol/L=11.8mol/L,配制250mL0.1mol?L-1的盐酸溶液,故需要250mL容量瓶,令需浓盐酸的体积为V,根据稀释定律,稀释前后溶质的物质的量不变,所以×11.8mol/L=250mL×0.1mol/L,解得:V=2.1mL,配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取(用到胶头滴管)称量,在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为除了250mL容量瓶外还有:玻璃棒、烧杯、胶头滴管、量筒;(2)所以操作步骤的顺序为BCAFED;(3)烧杯壁沾有溶质,将洗涤液都移入容量瓶,保证溶质全部转移到容量瓶内;(4)没有将洗涤液转移入容量瓶,溶质有损失,故浓度偏低,加蒸馏水超过了刻度,则溶液的体积偏大,浓度偏低,定容时俯视,溶液的体积偏小,浓度偏高,未将溶液冷却就转移,液体受热膨胀,冷却后体积偏小,浓度偏高,(5)加蒸馏水超过刻度线只能重新配制。
考点:溶液的配制和误差分析。
本题难度:一般
2、填空题 取1.43 g Na2CO3?xH2O溶于水配成10mL溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸2.0mL,并收集到112mLCO2(标况)。
求:(1)稀盐酸物质的量浓度为 mol?L-1
(2)Na2CO3?xH2O的摩尔质量为 g?mol-1
(3)x=
参考答案:(1)5 (2)286 (3)10
本题解析:根据反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O计算;n(CO2)=0.005mol,
Na2CO3+2HCl=2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)=5.0mol/L,
(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,
(3)由摩尔质量可知:106+18x=286,x=10。
考点:考查化学方程式的计算
本题难度:一般
3、选择题 等质量的Fe2O3和MgO粉末分别完全溶解于相同体积的稀硫酸中,得到的Fe2(SO4)3和MgSO4溶液的浓度分别为a mol/L和b mol/L,则a 和b的关系正确的是
A.a ="=" b
B.2a ="=" b
C.4a ="=" b
D.a ="=" 4 b
参考答案:C
本题解析:设质量为mg,Fe2O3和MgO的物质的量分别为m/160 mol、m/40 mol,两种物质都溶解,根据质量守恒定律,a: b=" (m/160):(" m/40)=1:4,即4a ="=" b。故选C。
点评:本题考查学生利用离子反应方程式的计算,明确金属离子与氢氧根离子的关系,盐中金属离子与硫酸根离子的关系是解答本题的关键,难度不大。
本题难度:简单
4、选择题 下列溶液中c(Cl-)与50mL1mol?L-1AlCl3溶液中c(Cl-)相等的是( )
A.150mL1mol?L-1NaCl溶液
B.75mL2mol?L-1CaCl2溶液
C.150mL2mol?L-1KCl溶液
D.75mL1mol?L-1FeCl3溶液
参考答案:50mL1mol?L-1AlCl3溶液中c(Cl-)=1mol?L-1×3=3mol/L;
A、150ml1mol?L-1NaCl溶液中c(Cl-)=1mol/L×1=1mol/L;
B、75ml2mol?L-1CaCl2溶液中c(Cl-)=2mol/L×2=4mol/L;
C、150ml2mol?L-1KCl溶液中c(Cl-)=2mol/L×1=2mol/L;
D、75ml1mol?L-1FeCl3溶液中c(Cl-)=1mol/L×3=3mol/L;
故选:D.
本题解析:
本题难度:一般
5、选择题 工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:
2FeCl3 + Cu = 2FeCl2?+ CuCl2 。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
A.0.5mol·L—1
B.1.5 mol·L—1
C.0.4 mol·L—1
D.0.25 mol·L—1
参考答案:B
本题解析:根据反应方程式2FeCl3 + Cu = 2FeCl2?+ CuCl2,设CuCl2的物质的量浓度为a ,则FeCl2 的物质的量浓度为2a,根据电荷守恒:3c(Fe3+)+2c(Fe2+)+2c(Cu2+)=c(Cl-),c(Cl-)="17.22g÷143.5" g·molˉ1
÷0.01L="12" mol·L—1,可得:3×1+2×2a+2a=12,故a=1.5,即c(Cu2+)="1.5" mol·L—1。
本题难度:一般