1、填空题 (8分)把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g) ="==" CO2(g) (1mol碳单质反应放热Q1 kJ)
途径Ⅱ:先制水煤气
C(s)+H2O(g)===CO(g)+H2(g) (1mol碳单质反应吸热Q2 kJ)
再燃烧水煤气
(1molCO和1molH2反应共放热Q3 kJ)
|
 2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)
2CO(g)+O2(g) ="==" 2CO2(g)2H2(g)+O2(g) =2H2O(g)
试回答下列问题:
(1)当等物质的量的单质碳反应时,途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是__________________。
(3)由于制取水煤气反应是吸热反应,所以反应物所具有的总能量________(填“大于”、“等于”或“小于”)生成物所具有的总能量。
(4)简述煤通过途径Ⅱ作为燃料的意义: 。
2、选择题 能大量共存于同一溶液,加入NaOH溶液也没有新的离子反应发生的是
A.Na+、K+、SO42-、[Al(OH)4]-
B.Fe3+、Ca2+、I-、NO3-
C.K+、NH4+、SO42-、Br-
D.Mg2+、Ca2+、HCO3-、Cl-
3、选择题 下列化合物中既有离子键又有共价键和配位键的是?(?)
A.KF
B.H2SO4
C.CuCl2
D.NH4Cl
4、填空题 (14分)运用化学反应原理分析解答以下问题
(1)已知: ①CO(g)+2H2(g)  CH3OH(g) △Hl= -91kJ·mol-l
CH3OH(g) △Hl= -91kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)
CH3OCH3(g)+H2O(g) △H2= -24 kJ·mol-l ③CO(g) +H2O(g)  CO2(g)+H2(g) △H3= -41 kJ·mol-l
CO2(g)+H2(g) △H3= -41 kJ·mol-l
且三个反应的平衡常数依次为K1、K2、K3
 则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
则反应 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g) △H= .
化学平衡常数K= (用含K1、K2、K3的代数式表示)。
(2)一定条件下,若将体积比为1:2的CO和H2气体通入体积一定的密闭容器中发生反应
 3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
3CO(g) +3H2(g) CH3OCH3(g) +CO2(g),下列能说明反应达到平衡状态是 。
a.体系压强保持不变 B.混合气体密度保持不变
c. CO和H2的物质的量保持不变 d.CO的消耗速度等于CO2的生成速率
(3)氨气溶于水得到氨水。在25℃下,将x mol.L-l的氨水与y mol.L-1的盐酸等体积混合,反应后溶液显中性,则c(NH4+)____c(Cl-)(填“>”、“<”、“=”);用含x和y的代数式表示出氨水的电离平衡常数 .
(4)科学家发明了使NH3直接用于燃料电池的方法,其装置用铂黑作电极、加入电解质溶液中,一个电极通入空气,另一电极通入NH3。其电池反应式为:4NH3+3O2 = 2N2+6H2O,电解质溶液应显 (填“酸性”、“中性”、“碱性”),
写出正极的电极反应方程式 .
5、选择题 已知25℃、101 kPa下,拆开1 mol C—H键要吸收415 kJ的能量,拆开1 mol C—C键要吸收331 kJ的能量,拆开1 mol O2中的O==O键要吸收498 kJ的能量,形成水分子中的1 mol H—O键要放出465 kJ的能量,形成二氧化碳分子中的1 mol C==O键要放出798 kJ的能量。在丙烷燃烧过程中不考虑其他能量转化,
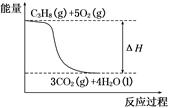
下列说法正确的是
A.丙烷完全燃烧的热化学方程式为C3H8+5O2===3CO2+4H2O ΔH=-2 036 kJ/mol
B.C3H8(g)+5O2(g)===3CO2(g)+4H2O(g);ΔH<-2 036 kJ/mol
C.丙烷完全燃烧的热化学方程式为:C3H8(g)+5O2(g)===3CO2(g)+4H2O(l) ΔH=2 036 kJ/mol
D.丙烷燃烧的能量变化可用上图表示