微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是________________。
(2)若在烧瓶中放入1.30 g锌粒,与c mol/L H2SO4反应,为保证实验结论可靠,量气管的适宜规格是(填字母)____。
A.100 mL B.200 mL C.400 mL D.500 mL
(3)若1.30 g锌粒完全溶解,氢氧化钠洗气瓶增重0.64 g(烧瓶中残留气体忽略不计,下同),则圆底烧 瓶中发生反应的化学方程式为______________________。
(4)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重bg,量气管中收集到V mL气体(标准状况),请用一个代数式表示出a、b、V之间的关系___________。
(5)若撤走盛有无水氯化钙的U形管,则n(H2)/n(SO2)的数值将____(填“偏大”、“偏小”或 “无影响”)。
(6)反应结束后,为了准确地测量气体体积,读数时应注意的事项是:_________、__________
参考答案:(1)关闭分液漏斗活塞,向右侧球形管中加入水,一段时间后观察
本题解析:
本题难度:一般
2、实验题 (15分)通过测量一定质量的Fe、Al合金与M的溶液反应生成H2在标准状况下的体积,可以计算出合金中Fe、Al的旗量分数,若用下图装置来制取H2,请完成下列操作步骤直至产生H2。
 ?
?
(1)C处塞入玻璃丝绒团;
(2) A处 ___________________________
(3) B处_____________________________
(4) ____________________________________
(5) ____________________________________;
(6) 在分液櫬斗中加入M的溶液。
(7) ______________________________________________________
参考答案:(2)A处插入分液漏斗(3) B处插入带有橡皮管和止水夹的玻
本题解析:本题考查Fe、Al的性质及实验设计。要测定Fe、Al的旗量分数,先要测定出Fe或Al的质量,根据Fe、Al的性质,应让混合物NaOH溶液反应,此时只有Al发生反应放出H2,根据H2体积就可以计算出Al的质量,从而计算出Fe、Al的质量分数。
本题难度:一般
3、选择题 下表中实验操作能达到实验目的的是???????
?
| 实验操作
| 实验  目的 目的
|
A
| 向甲酸钠溶液中加新制的Cu(OH)2并加热
| 确定甲酸钠中含有醛基
|
B
| 向苯酚的饱和溶液中滴加稀溴水
| 看到三溴苯酚沉淀
|
C
| 向酒 精和醋酸的混合液中加入金属钠 精和醋酸的混合液中加入金属钠
| 确定酒精中混有醋酸
|
?? D
| 将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
| 检验水解产物中的溴离子
参考答案:A
本题解析:略
本题难度:简单
4、实验题 某学生试图用电解法根据电极上析出的物质的质量来测定阿伏加德罗常数值。其实验方案的要点为:
①用直流电电解氯化铜溶液,所用仪器如图;
②在电流强度为I安培,通电时间为t分钟后,精确测得某电极上析出的铜的质量为m克。
试回答

(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示)E接____,C接____,____接F。
(2)写出B电极上发生反应的离子方程式____________,G试管中淀粉KI溶液变化的现象为____________;相应的离子方程式是____________________
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是_____(选填下列操作步骤的编号)。
①称量电解前电极质量;②刮下电解后电极上的铜并清洗;③用蒸馏水清洗电解后电极;
④低温烘干电极后称量;⑤低温烘干刮下的铜后称量;⑥再次低温烘干后称量至恒重。
(4)已知电子的电量为1.6×10-19库仑。试列出阿伏加德罗常数的计算表达式:NA=____________。
参考答案:(1)D、A、B
(2)2Cl--2e-=Cl2↑;溶
本题解析:
本题难度:一般
5、选择题 工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下,对下述流程中的判断正确的是:
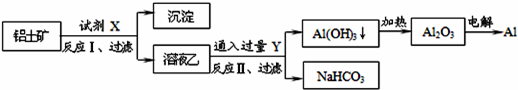
A.试剂X为稀硫酸,沉淀中含有硅的化合物
B.反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
C.结合质子(H+)的能力由弱到强的顺序是OH->CO32->AlO2-
D.Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
参考答案:B
本题解析:
试题分析:A、Al2O3、Fe2O3和硫酸反应,SiO2和硫酸不反应,要将氧化铝和其他两种分离出来,应该选择氢氧化钠,将氧化铝溶解为偏铝酸钠,则固体难溶物是氧化铁和二氧化硅,即试剂X为氢氧化钠,沉淀中含有二氧化硅和氧化铁,故A错误;
B、铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)中加入过量的氢氧化钠以后会生成偏铝酸钠溶液,偏铝酸盐中通二氧化碳来获得氢氧化铝沉淀,即CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,故B正确;
C、结合质子的能力就是指碱性,结合质子能力越强,相应的酸放出质子的能力就越弱,其对应的酸的酸性就越弱,显然酸性强弱HCO3->Al(OH)3>H2O,碱性:OH->AlO2->CO32-,所以结合质子能力:OH->AlO2->CO32-,故C错误;
D、氯化铝是分子晶体,熔融时不存在铝离子,电解熔融的氯化铝不能获得金属铝,故D错误.
故选B。
本题难度:一般
|