微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学平衡常数(K)、电离常数(Ka、Kb)、溶度积常数(Ksp)等常数是表示、判断物质性质的重要常数,下列关于这些常数的说法中,正确的是 [???? ]
A.化学平衡常数的大小与温度、浓度、压强有关,与催化剂无关
B.Ka(HCN)<Ka(CH3COOH)说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
C.向氯化钡溶液中加入同浓度的碳酸钠和硫酸钠溶液,先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3)
D.当温度升高时,弱酸、弱碱的电离常数(Ka、Kb)变大
参考答案:D
本题解析:
本题难度:一般
2、填空题 (4分)已知[Ksp(AgBr) ]=5.4×10-13,[Ksp(AgCl) ]=2.0×10-10。
(1)向浓度均为0.1mol·L-1的KBr、NaCl混合溶液中滴入0.1mol·L-1的AgNO3溶液,首先生成的沉淀是???????????。
(2)当容器中同时出现AgCl和AgBr沉淀,溶液中c(Br-)/c(Cl-)=??????????????。
参考答案:(1)AgBr(1分)??(2)c(Br-)/c(Cl-)=
本题解析:(1)根据溶度积常数表达式可知,要生成溴化银沉淀,则银离子的最低浓度是
 。同理可知要生成氯化银沉淀,需要银离子浓度的最低值是
。同理可知要生成氯化银沉淀,需要银离子浓度的最低值是
2.0×10-9mol/L,因此首先生成的是溴化银沉淀。
(2)当容器中同时出现AgCl和AgBr沉淀,则同时是二者的饱和溶液,则
c(Br-)·c(Ag+)/c
本题难度:一般
3、选择题 下列化学实验事实及其解释或结论都正确的是(????)
A.取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+
B.用乙醇、冰醋酸及pH=0的H2SO4加热可制乙酸乙酯,用饱和的Na2CO3溶液可以洗去其中含有的乙醇和乙酸,说明乙酸乙酯在Na2CO3溶液中的溶解度很小
C.向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,首先生成蓝色沉淀,说明Ksp[Cu(OH)2] >Ksp[Mg(OH)2]
D.配制0.10mol/L NaCl溶液,俯视容量瓶的刻度线定容,所配溶液浓度偏大
参考答案:D
本题解析:
试题分析:A、取少量溶液X,向其中加入适量新制氯水,若有Fe2+,已经被氧化为Fe3+,再加KSCN溶液,溶液变红,不能说明原溶液中有Fe2+,错误;B、用乙醇、冰醋酸及浓H2SO4加热才可以制乙酸乙酯,错误;C、向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,若先生成蓝色沉淀,说明氢氧化铜的溶度积常数小,错误;D、配制溶液,俯视刻度线,体积变小,浓度偏大,正确。
本题难度:一般
4、填空题 (16分)氨气是一种重要的化工产品及工业原料。
I.某温度下,合成氨反应的平衡常数K=3.0×103(mol/L)-1,
(1)写出其对应的化学方程式____________________________________________________ 。
(2)某温度下,如果在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则反应_______(填“正向进行”或“逆向进行”或“达到平衡”)。
(3)该温度下,在体积恒定为10L的四个密闭容器中分别充入下列物质,反应达到平衡后,N2的转化率最大的是___________________。
a.10molN2、30molH2和20molNH3 b.10molN2和30molH2
c.20molN2和60molH2 d.10molN2和28molH2
II.氨气极易溶于水,氨水是氨气溶于水而形成的溶液,回答下列问题:
(4)在氨水溶液中加水稀释的过程,NH3·H2O的电离程度___________(填“增大”“减小”或“不变”),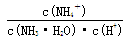 ___________(同上)。
___________(同上)。
(5)室温下,a mol/L的(NH4)2SO4水溶液的pH=5,原因是溶液中存在平衡________________________(用离子方程式表示)。并计算该平衡的平衡常数表达式为________________________(用含代数a的较为精确的数学表达式表示,不必化简,不做近似运算)。
(6)室温下,向浓度均为0.1mol/L的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为_________________________________________。
(已知:室温时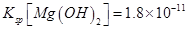 mol3
mol3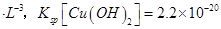 mol3.L-3).
mol3.L-3).
参考答案:Ⅰ. (1)1/2 N2 + 3/2 H2
本题解析:
试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据平衡常数可知反应的化学方程式为1/2 N2 + 3/2 H2 NH3。
NH3。
(2)在体积恒定为10L的密闭容器中充入:0.1molN2、0.1molH2和2molNH3则产生浓度熵为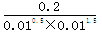 =2000<3000,所以反应向正反应方向进行。
=2000<3000,所以反应向正反应方向进行。
(3)a与b相比,a中含有大量的氨气,因此b中氨气的转化率大于a中。b与d相比,b中氢气浓度大,大转化率高;由于正方应是体积减小的可逆反应,所以增大压强平衡向正反应方向进行,c与b相比,相当于是在b的基础上增大压强,氮气转化率增大,答案选c。
(4)稀释促进氨水的电离,电离程度增大。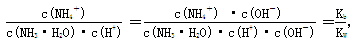 ,因此比值不变。
,因此比值不变。
(5)铵根水解溶液显酸性,方程式为NH4++H2O NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O
NH3?H2O+H+。室温下,在a mol?L-1的(NH4)2SO4水溶液中pH=5,溶液中c(H+)=10-5mol/L,故溶液中c(OH-)=10-9mol/L,根据电荷守恒有:c(NH4+)+c(H+)=c(OH-)+2c(SO42-),即c(NH4+)+10-5mol/L=10-9mol/L+2amol/L,则c(NH4+)=(2a+10-9-10-5)mol/L,根据物料守恒计算溶液中c(NH3?H2O)=2amol/L-(2a+10-9-10-5)mol/L=(10-5-10-9)mol/L,故NH4++H2O NH3?H2O+H+的平衡常数的表达式为
NH3?H2O+H+的平衡常数的表达式为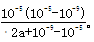 。
。
(6)溶度积常数越小的物质越先沉淀,氢氧化铜的溶度积小于氢氧化镁的溶度积,所以氢氧化铜先沉淀,铜离子和氨水反应生成氢氧化铜沉淀和铵根离子,离子方程式为Cu2++2NH3?H2O=Cu(OH)2↓+2NH4+。
考点:考查平衡常数计算与应用、外界条件对电离平衡的影响、盐类水解以及溶度积常数应用等
本题难度:困难
5、填空题 研究人员研制利用低品位软锰矿浆(主要成分是MnO2)吸收硫酸厂的尾气SO2,制备硫酸锰的生产流程如下:

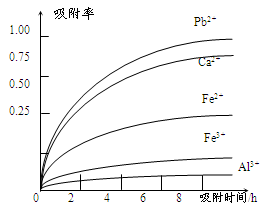
已知:浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+、Ca2+、Pb2+等其他金属离子。PbO2的氧化性大于MnO2。PbSO4是一种微溶物质。有关金属离子的半径、形成氢氧化物沉淀时的pH见下表,阳离子吸附剂吸附金属离子的效果见下图。
离子
| 离子半径(pm)
| 开始沉淀
时的pH
| 完全沉淀
时的pH
|
Fe2+
| 74
| 7.6
| 9.7
|
Fe3+
| 64
| 2.7
| 3.7
|
Al3+
| 50
| 3.8
| 4.7
|
Mn2+
| 80
| 8.3
| 9.8
|
Pb2+
| 121
| 8.0
| 8.8
|
Ca2+
| 99
| -
| -
请回答下列问题:
(1)写出浸出过程中生成Mn2+反应的化学方程式 。
(2)氧化过程中主要反应的离子方程式 。
(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是 ,应调节pH的范围为 。
(4)阳离子吸附剂可用于除去杂质金属离子。请依据图、表信息回答,决定阳离子吸附剂吸附效果的因素有 、 等;吸附步骤除去的主要离子为: 。
(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol·L—1CaCl2溶液与2.00×10—2 mol·L—1Na2SO4溶液等体积混合(忽略体积的变化),则生成沉淀时,c的最小值是 。
参考答案:(1)SO2+MnO2=MnSO4 (2)2Fe2
本题解析:
试题分析:(1)根据题意在浸出过程中生成Mn2+反应的化学方程式为SO2+MnO2=MnSO4;(2)将Fe2+氧化为Fe3+过程中主要反应的离子方程式为2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O。(3)在氧化后的液体中加入石灰浆,用于调节pH值,此处调节pH值用到的仪器是pH计。使Fe3+沉淀完全的pH为3.7,而Mn2+开始形成沉淀的pH为8.3。因此应调节pH的范围为4.7 ≤pH<8.3。(4)根据题目提供的表格数据可知决定阳离子吸附剂吸附效果的因素有吸附时间、金属离子的半径 、金属离子的电荷;吸附步骤除去的主要离子为Pb2+、Ca2+。(5)CaSO4是一种微溶物质,已知Ksp(CaSO4)=9.10×10—6。现将c mol/LCaCl2溶液与2.00×10—2 mol/LNa2SO4溶液等体积混合,由于忽略体积的变化,所以混合后氯化钙和硫酸钠溶液的浓度都要减半;c(SO42-)=1.00×10—2 mol/L. c(Ca2+)=c/2mol/L.由于Ksp(CaSO4)= 9.10×10—6,c(SO42-)·c(Ca2+)≥9.10×10—6,则生成沉淀时c(Ca2+)≥(9.10×10—6÷1.00×10—2 mol/L)×2=1.82×10-3mol/L。因此c的最小值是1.82×10-3mol/L.
考点:考查化学反应原理、影响离子吸收的因素及沉淀溶解平衡和溶度积的计算的知识。
本题难度:困难
|