微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似,请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有________。
A.去除油污
B.溶解镀锌层
C.去除铁锈
D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是________。
(3)由溶液B制取Fe3O4胶体粒子的过程中,须持续通入N2,其原因是
_______________________________________________________________
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离?__________(填“能”或“不能”),理由是________________________________。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.010 00 mol·L-1的K2Cr2O7标准溶液250 mL,应准确称取________ g K2Cr2O7(保留4位有效数字,已知MK2Cr2O7=294.0 g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有________(用编号表示)。
①电子天平 ②烧杯 ③量筒 ④玻璃棒
⑤容量瓶?⑥胶头滴管 ⑦移液管
(6) 滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将________(填“偏大”、“偏小”或“不变”)。
参考答案:(1)AB
(2)抽滤、洗涤、灼烧
(3)N2气
本题解析:结合题目提供的信息及制备Fe3O4胶体粒子和ZnO的流程图,运用已有知识分析、解决问题。
(1)由于Zn的性质与Al的相似,可溶于NaOH溶液,因此用NaOH溶液处理废旧镀锌铁皮,除去表面的油污后,可将镀层锌溶解。
(2)调节溶液A的pH产生Zn(OH)2沉淀,然后过滤、洗涤、灼烧使Zn(OH)2分解为ZnO。考虑Zn(OH)2与Al(OH)3的性质相似,应为絮状沉淀物,过滤速度较慢,这里可采用抽滤,加快过滤速度。
(3)溶液B中含有Fe2+、Fe3+,加入NaOH溶液、加热,可得Fe3
本题难度:困难
2、填空题 (13分)Ⅰ、短周期元素X、Y、Z在元素周期表中的相对位置如下图所示。
|
|
| X
|
Y
|
|
| Z
25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13。
(1)Y的离子结构示意图为 。
(2)X、Z的气态氢化物稳定性较强的是 (填化学式)。
(3)不能用带磨口玻璃塞的试剂瓶盛装M溶液的原因是 (用离子方程式表示)。
(4)工业上,用X单质制取Z单质的化学方程式为 。
(5)X的最高价氧化物与某一元有机酸的钾盐(化学式为KA,A-为酸根)溶液反应的化学方程式为 。(已知25℃,X的最高价氧化物的水化物的电离常数为Kal =4.2×10-7,Ka2=5.6×10-11;HA的电离常数Ka=1.1×10-10)
Ⅱ、碳和氮的化合物与人类生产、生活密切相关。低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表: H2(g) + CO2(g)的平衡常数随温度的变化如下表:
温度/℃
| 400
| 500
| 平衡常数
| 9.94
| 9
请回答下列问题:
(6)上述正反应方向是 反应(填“放热”或“吸热”)。
(7)写出该反应的化学平衡常数表达式:K= 。
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为 ;K值为 。
(9)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g)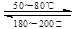 Ni(CO)4(g),ΔH<0。 Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移,ΔH减小
C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低
D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
参考答案:
I、(1) 本题解析: 本题解析:
试题分析:I、25℃,0.1 mol·L-1M溶液(M为Y的最高价氧化物的水化物)的pH为13,说明M是强碱,根据X、Y、Z在元素周期表中的位置判断Y是Na元素,对应的最高价氧化物的水化物是氢氧化钠,为强碱;则X是C元素,Z是Si元素。
(1)Na的离子结构示意图为 ; ;
(2)C的非金属性大于Si,所以C的气态氢化物CH4的稳定性较强;
(3)因为氢氧化钠与玻璃塞中的二氧化硅反应生成粘性较大的硅酸钠,所以不能用带磨口玻璃塞的试剂瓶盛装氢氧化钠溶液,离子方程式是SiO2+2OH-=SiO32-+H2O;
(4)工业上用单质碳还原二氧化硅制取Si单质,化学方程式是SiO2+C Si+CO↑; Si+CO↑;
(5)根据所给酸的电离常数可知,酸性H2CO3>HA>HCO3-,所以二氧化碳与KA溶液反应只能生成碳酸氢钾和HA,则化学方程式是KA+CO2+H2O=HA+KHCO3。
II、(6)温度升高,平衡常数减小,说明升高温度,平衡逆向移动,则该反应是放热反应;
(7)根据平衡常数的定义,该反应的平衡常数K=c(H2)c(CO2)/c(CO)c(H2O);
(8)830K时,若起始时:C(CO)=2mol/L,C(H2O)=3mol/L,平衡时CO的转化率为60%,则平衡时c(H2)=c(CO2)=2mol/L×60%=1.2mol/L,消耗水蒸气的浓度也是1.2mol/L,则水蒸气的转化率为1.2mol/L/3mol/L×100%=40%;平衡时水蒸气的浓度是3mol/L-1.2mol/L=1.8mol/L,CO的浓度是2mol/L-1.2mol/L=0.8mol/L,代入K=c(H2)c(CO2)/c(CO)c(H2O),则该温度下的平衡常数是1.22/(0.8×1.8)=1;
(9)A、Ni为固体,增加Ni的量,平衡不移动,CO的转化率不变,错误;B、缩小容器容积,压强增大,平衡右移,但ΔH不变,错误;C、反应达到平衡后,充入CO,相当于增大压强,平衡正向移动,则再次达到平衡时,CO的体积分数减小,正确;D、因为该反应有固体参加,气体的总质量分数变化,达到平衡时气体的质量不再变化,则气体的密度不变,所以当容器中混合气体密度不变时,可说明反应已达化学平衡状态,而4v正[Ni(CO)4]= v正(CO)表示正反应速率,不符合正逆反应速率相等的特征,不能判断平衡的到达,错误,答案选C。
考点:考查元素推断,化学用语的书写,化学平衡的移动机平衡常数的应用
本题难度:困难
3、简答题 下列说法中,正确的是( )
A.难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀和溶解即停止
B.Ksp越小,难溶电解质在水中的溶解能力一定越弱
C.Ksp的大小与离子浓度无关,只与难溶电解质的性质和温度有关
D.相同温度下,AgCl在水中的溶解能力与在NaCl溶液中的相同
参考答案:A、难溶电解质在水溶液中达到沉淀溶解平衡时,沉淀溶解平衡是动
本题解析:
本题难度:一般
4、填空题 (7分)(1)现有反应:CO(g)+H2O(g)? CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O, CO2(g)+H2(g)? △H>0。在850℃时,K=1。?此温度下,若向一容积可变的密闭容器中同时充入1.0 mol CO,3.0 mol H2O,
1.0 mol CO2和x mol H2,则:
①当x=5.0时,上述反应向???? ???????方向进行。?
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是????? ???。
③在850℃时,若设x=5.0和x=6.0,其他物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a???? b(填“大于”“小于”或“等于”)。
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,它的Ksp=2.8×10—9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×10—4mo1/L ,则生成沉淀所需CaCl2溶液的最小浓度为???????????????????。
参考答案:(7分,除标注外每空2分)?
(1)①逆反应(1分)?
本题解析:略
本题难度:一般
5、选择题 已知:Ksp(Ag2SO4)=1.4×10-5,Ksp(BaSO4)=1.1×10-10,Ksp(CaSO4)=9.1×10-6,Ksp(BaCO3)=2.6×10-9。则下列说法中不正确的是 [???? ]
A.有关的四种盐中溶解性最强的是Ag2SO4
B.有关的三种硫酸盐中,其饱和溶液中硫酸根离子浓度最小的是BaSO4
C.CaSO4沉淀能较容易地转化成为BaSO4沉淀
D.BaSO4沉淀不可能会转化成BaCO3沉淀
参考答案:D
本题解析:
本题难度:一般
|
|