微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知Ag2SO4的Kw为2.0×10-3,将适量Ag2SO4固体溶于100 mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如图〔饱和Ag2SO4溶液中c(Ag+)=0.034 mol·L-1〕。若t1时刻在上述体系中加入100 mL0.020 mol·L-1 Na2SO4溶液,下列示意图中,能正确表示t1时刻后Ag+和SO42-浓度随时间变化关系的是
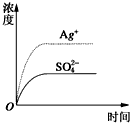 [???? ]
[???? ]
A.
B.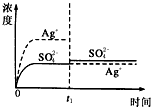
C.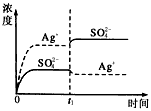
D.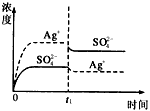
2、选择题 把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)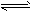 Ca2+(aq)+2OH-(aq)。当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是[???? ]
Ca2+(aq)+2OH-(aq)。当向悬浊液中加入少量生石灰后,若温度保持不变,下列判断正确的是[???? ]
A.溶液的pH增大
B.溶液的pH不变
C.溶液中Ca2+数目增多
D.溶液中c(Ca2+)增大
3、填空题 (10分)(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理____________。
(2)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原 成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为_________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32,溶液的pH至少为 ,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg?L—1的废水,需用绿矾的质量为 kg。(写出计算过程,保留到小数点后一位)
4、简答题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+
1
2
O2?SO3△H=-98KJ?mol-1
(1)在T1温度时,该反应的平衡常数K=10
3
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,c(CO
2-3
)
c(SO
2-4
)
=______.[已知该温度时,KSP(BaSO4)=1.3×10-10,KSP(BaCO3)=5.2×10-9].
5、选择题 氯化银在水中存在AgCl(s)  ?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是 ?Ag+(aq)+Cl-(aq)溶解平衡,现将足量氯化银分别放入同温下的:①100mL蒸馏水中,②100mL0.1mol·L-1盐酸中,③100mL0.1mol·L-1氯化铝溶液中,④100mL0.1mol·L-1氯化镁溶液中。充分搅拌后,银离子浓度由大到小的顺序是
A.①②③④
B.③④①②
C.①②④③
D.③④②①
|
网站客服QQ: 960335752 - 14613519 - 791315772
|
|