微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有甲、乙两个装置,下列说法错误的是

A.甲、乙装置中,Zn的质量均减小
B.甲、乙装置中,Cu上均有气泡产生
C.化学反应速率乙 > 甲
D.甲中H+移向Zn,乙中SO42-移向Zn
参考答案:B
本题解析:略
本题难度:简单
2、选择题 现代生产、生活和国防中大量使用电池。下列有关电池的说法正确的是
A.碱性锌锰电池性能好于普通电池的原因是能反复使用
B.碱性锌锰电池的正极是MnO2,当电池中有6.5g Zn反应时,将产生0.2molMnOOH
C.铅蓄电池放电时,负极的质量减少
D.使用碱性电解质的氢氧燃料电池,负极的电极反应是H2 - 2e- = 2H+
参考答案:B
本题解析:
试题分析:碱性锌锰电池和普通电池都是一次电池,不能反复使用,A错误;碱性锌锰电池总反应是Zn+2MnO2+2H2O=Zn(OH)2+2MnO(OH )~2e-,当消耗1molZn时,生成2molMnO(OH),B正确;铅蓄电池放电时,负极反应为Pb-2e-+SO42-=PbSO4,质量增加,C错误;碱性氢氧燃料电池,负极电极反应式为H2-2e-+2OH-=2H2O,D错误。
点评:书写原电池电极反应要注意介质,注意负极生成的离子与溶液中阴离子是否共存。同时注意正负极反应式相加得到原电池总反应
本题难度:一般
3、选择题 铜片和锌片用导线连接后插入稀硫酸中,电解质溶液的pH [???? ]
A.不变
B.先变小后变大
C.逐渐变小
D.逐渐变大
参考答案:D
本题解析:
本题难度:一般
4、选择题 研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是
A.水既是氧化剂又是溶剂
B.放电时正极上有氢气生成
C.放电时OH-向正极移动
D.总反应为:2Li+2H2O="==" 2LiOH+H2↑
参考答案:C
本题解析:考生可能迅速选出C项是错误,因为原电池放电时OH-是向负极移动的。这个考点在备考时训练多次。这种电池名称叫锂水电池。可推测其总反应为:2Li+2H2O="==" ?2LiOH+H2↑。再写出其电极反应如下:(—)2Li—2e—=2Li+???(+)2H2O+2e—=2OH—+H2↑
结合选项分析A、B、D都是正确的。此题情景是取材于新的化学电源,知识落脚点是基础,对原电池原理掌握的学生来说是比较容易的。
本题难度:一般
5、选择题 下列说法正确的是
A.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: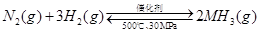 △H=-38.6kJ·mol-1
△H=-38.6kJ·mol-1
B.10mL 0.5mol/L CH3COONa溶液与6mL 1mol/L盐酸混合:c(Cl-)>c(CH3COOH) >c(Na+)>c(H+)>c(OH-)
C.实验测得环己烷(l)、环己烯(l)和苯(l)的标准燃烧热分别为-3916 kJ/mol、-3747 kJ/mol和-3265 kJ/mol,可以证明在苯分子中不存在独立的碳碳双键
D.在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应时溶液中c(NH4+)=c(Cl—)。用含a的代数式表示NH3·H2O的电离常数Kb=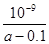
参考答案:C
本题解析:A不正确,因为是可逆反应,无法确定转化率,所以不能计算反应热。B不正确,因为醋酸要电离,所以醋酸的浓度不可能大于钠离子的浓度。环己烯(l)与环己烷(l)相比,形成一个双键,能量降低169kJ/mol,苯(l)与环己烷(l)相比,能量降低691kJ/mol,远大于169×3,说明苯环有特殊稳定结构,所以C正确。D中根据电荷守恒可知,溶液显中性,所以OH-的浓度是10-7mol/L,而溶液中c(NH4+)=0.005mol/L,剩余氨水的浓度是 本题难度:一般
本题难度:一般