微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学平衡常数(K)、弱酸的电离常数(Ka)、难溶物的溶度积常数(KSP)是判断物质性质或变化的重要的平衡常数.下列关于这些常数的说法中,正确的是(?? )
A.平衡常数的大小与温度、浓度、压强、催化剂等有关
B.当温度升高时,弱酸的电离常数Ka变小
C.KSP(AgCl)>KSP(AgI),由此可以判断AgCl(s)+I-=AgI(s)+Cl-能够发生
D.Ka(HCN)<Ka(CH3COOH),说明相同物质的量浓度时,氢氰酸的酸性比醋酸强
参考答案:C
本题解析:
本题难度:简单
2、选择题 已知反应A2(g)+2B2(g)?2AB2(g)的△H<0,下列说法正确的是( )
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,减小压强有利于该反应平衡正向移动
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.升高温度有利于反应速率增加,从而缩短达到平衡的时间
参考答案:A、升高温度正、逆反应速率都增大,该反应正反应是放热反应,逆
本题解析:
本题难度:一般
3、选择题 恒温下在密闭容器中进行的反应2SO2 + O2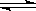 2SO3 达到平衡状态的标志是
2SO3 达到平衡状态的标志是
A.容器中SO2、O2、SO3共存
B.容器中SO2和SO3 浓度相同
C.容器中n(SO2)∶n(O2)∶n(SO3)=2∶1∶2
D.容器中压强不随时间而改变
参考答案:D
本题解析:
试题分析:化学反应达到平衡状态的两个标志:各物质的浓度不再变化、同种物质的生成速率和消耗速率相等。A.容器中SO2、O2、SO3共存,这是可逆反应的基本特征,不能说明各物质的浓度不变,错;B.容器中SO2和SO3 浓度相同不能说明它们的浓度不再变化,错;C.容器中n(SO2)∶n(O2)∶n(SO3)=2∶1∶2 ,也不能说明物质的浓度不再变化,错;该反应是气体体积变化的反应,如果反应没有达到平衡,气体的物质的量会发生变化,压强也会发生变化,压强不变说明气体的生成和消耗相等,则反应达到了平衡,D对,选D。
考点:化学平衡状态的判断。
本题难度:一般
4、填空题 工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:CO(g)+2H2(g)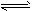 CH3OH(g) △H
CH3OH(g) △H
(1)判断反应达到平衡状态的依据是(填字母序号,下同)____。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。

①由表中数据判断△H____0(填“>”“=”或“<”);
②某温度下,将2 mol CO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2
mol/L,则CO的转化率为_________,此时的温度为__________。
(3)要提高CO的转化率,可以采取的措施是__________。
a.升温 b.加入催化剂 c.增加CO的浓度 d.加入H2加压 e.加入惰性气体加压 f.分离出甲醇
(4)300℃、一定的压强下,5 mol CO与足量的H2在催化剂的作用下恰好完全反应变化的热量为454 kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下

下列说法正确的是_________。
A.2c1>c3 B.a+b<90.8 C.2P2<P3 D.a1+a3<1
参考答案:(1)CD
(2)①<;②80%;250℃
本题解析:
本题难度:一般
5、选择题 在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明平衡移动的是 [???? ]
A.反应混和物的浓度
B.反应物的转化率
C.正、逆反应速率
D.反应混和物的压强
参考答案:B
本题解析:
本题难度:一般