微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某温度下,在一容积不变的密闭容器中,A(g)+2B(g)?3C(g)达到平衡时,A.B和C的物质的量分别为3mol、2mol和4mol,若温度不变,向容器内的平衡混合物中再加入A、C各lmol,此时该平衡移动的方向为( )
A.向左移动
B.向右移动
C.不移动
D.无法判断
参考答案:方法一:假设容器体积为1L,达到平衡时,A、B和C的物质的量
本题解析:
本题难度:简单
2、填空题 接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:

(1)该反应所用的催化剂是___________(填写化合物名称),该反应450℃时的平衡常数________500℃时的平衡常数(填“大于”、“小于”或“等于”)。
(2)该热化学反应方程式的意义是____________。
(3)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molSO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则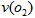 =___________mol/L·min:若继续通入0.20mol SO2和0.10mol O2,则平衡__________移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______mol<
=___________mol/L·min:若继续通入0.20mol SO2和0.10mol O2,则平衡__________移动(填“向正反应方向”、“向逆反应方向” 或“不”),再次达到平衡后,_______mol<
n(SO3)<________mol
参考答案:(1)五氧化二钒(V2O5);大于
(2)在450℃时
本题解析:
本题难度:一般
3、选择题 在一定条件下,密闭容器中发生可逆反应2X(g)+2Y(g) 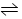 3Z(g)+2W(g),该X、Y的初始浓度分别为2.5 mol·L-1和2.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是
3Z(g)+2W(g),该X、Y的初始浓度分别为2.5 mol·L-1和2.0 mol·L-1,达平衡后,测出下列各生成物的浓度数据中肯定错误的是
A.c(Z)="1.5" mol·L-1
B.c(Z)="2.4" mol·L-1
C.c(W)="1.6" mol·L-1
D.c(W)="2.0" mol·L-1
参考答案:D
本题解析:
试题分析:可逆反应中,反应物不可能在反应中完全转化,由于反应中X、Y按照物质的量2:1反应,所以X过量0.5mol,生成3molZ,2molW,但反应不可能完全进行到底,所以0.5mol/L<C(X)<2.5mol/L;0<C(Z)<3mol/L;0<C(W)<2mol/L.故D一定错误,答案选D.
考点:化学反应的可逆性
本题难度:一般
4、选择题 在一固定容积的密闭容器中进行如下反应:2SO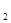 (g)+O
(g)+O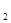 (g)
(g)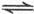 2SO
2SO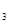 (g),已知反应进行到10秒时,SO
(g),已知反应进行到10秒时,SO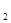 、O
、O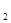 、SO
、SO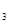 的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
的物质的量分别为0.2 mol、0.1 mol、0.2 mol,则下列说法正确的是
A.10秒时,用O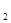 表示该反应的平均反应速率为0.01 mol/(L·s)
表示该反应的平均反应速率为0.01 mol/(L·s)
B.当反应达平衡时,SO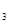 的物质的量可能为0.4 mol
的物质的量可能为0.4 mol
C.当SO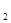 和O
和O 的生成速率之比为2:1时,达到该反应限度
的生成速率之比为2:1时,达到该反应限度
D.向容器内充人SO ,可以提高反应速率
,可以提高反应速率
参考答案:D
本题解析:
试题分析:反应进行到10s时生成三氧化硫0.2mol,则消耗氧气是0.1mol。由于不能确定容器的体积,所以不能计算该反应的反应速率是,A不正确;根据S原子守恒可知,SO2和SO3的物质的量之和是0.4mol,由于反应是可逆反应,反应物的转化率达不到100%,所以当反应达平衡时,SO3的物质的量不可能为0.4 mol,B不正确;反应速率之比是相应的化学计量数之比,所以二氧化硫和氧气的反应速率总是2:1的,C不正确;向容器内充人SO2,增大SO2的浓度,可以提高反应速率,D正确,答案选D。
点
本题难度:一般
5、选择题 可逆反应N2(g)+ 3H2(g) 
 2NH3 (g)达到平衡状态,下列说法中正确的是( )
2NH3 (g)达到平衡状态,下列说法中正确的是( )
A.该反应停止,N2和H2不再化合
B.N2、H2、NH3浓度不变
C.N2、H2、NH3浓度相等
D.N2、H2、NH3的物质的量之比为1:3:2
参考答案:B
本题解析:
试题分析:当可逆反应达到平衡状态时,反应仍然在进行,只是任何物质的消耗浓度与产生浓度相等,即浓度不发生变化,因此选项A错误,选项B正确;当反应达到平衡时N2、H2、NH3浓度可能相等,也可能不等,这与开始投入的物质的量的多少有关,选项C错误; D. N2、H2、NH3的物质的量改变之比为1:3:2,但是平衡时的浓度之比比一定是该数值,因此选项D错误。
考点:考查可逆反应平衡状态的特征及浓度、物质的量的关系的知识。
本题难度:一般