微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)在标准状况下,物质①4 g H2,② 33.6L CH4,③1mol H2O ,④3.01×1023个O2.(填序号,下同)
(1)质量最大的是____?????___,???(2)分子数最多的是_?__?__,
(3)原子数最少的是___???____,???(4)体积最小的是_???__??____.
(5)电子数最多的是___???____.
参考答案:(5分)各1分(1)②??(2)①?(3)④?(4)③?(5
本题解析:4g氢气的物质的量是2mol,含有4mol氢原子和4mol电子;标准状况下,33.6L甲烷的物质的量是1.5mol,含有7.5mol原子,含有15mol电子,质量是1.5mol×16g/mol=24g;1mol水的质量是18g,含有3mol原子和10mol电子;3.01×1023个O2的物质的量是0.5mol,含有1mol氧原子和8mol电子,其中氧气的质量是16g。所以质量最大的是②,分子数最多的是①,原子数最少的是④,体积最小的是③,电子数最多的是②。
本题难度:一般
2、填空题 (9分) 向浓度相等、体积均为50 mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100 mL。
(1)在KOH溶液中通入一定量的SO2气体后,溶液中溶质的组成可能是:
① ; ② ;
③ ; ④ 。
(2)在稀释后的溶液中逐滴加入0.1 mol/L的盐酸,产生SO2的体积(标准状况)与所加盐酸的体积关系如下图所示。
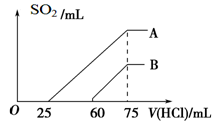
①A曲线表明,原溶液通入SO2气体后,所得溶质与盐酸反应产生SO2的最大体积是____mL(标准状况)。
②B曲线表明,原溶液通入SO2气体后,所得溶液中溶质的化学式为_________________。
③原KOH溶液的物质的量浓度为________ ____。
参考答案:(9分)
(1)① KOH、K2SO3&#
本题解析:
试题分析:(1)二氧化硫与氢氧化钾溶液反应时,若二氧化硫少量,与氢氧化钾恰好反应则生成亚硫酸钾,若二氧化硫过量与氢氧化钾恰好完全反应,则生成亚硫酸氢钾,所以二氧化硫与氢氧化钾溶液反应得到的溶液中溶质可能有四种可能:① KOH、K2SO3;②K2SO3;③ K2SO3、KHSO3; ④KHSO3;
(2)①因为亚硫酸根离子与盐酸反应生成亚硫酸氢根离子消耗盐酸的体积与亚硫酸氢根离子生成二氧化硫消耗盐酸的体积相等。A曲线开始无气体产生,且生成气体消耗的盐酸的体积大于无气体产生消耗的盐酸的体积,说明该溶液中的溶质为K2SO3、KHSO3,盐酸先与K2SO3反应生成KHSO3,消耗盐酸25mL,再与亚硫酸氢根离子反应生成二氧化硫共消耗盐酸50mL,所以溶液中K2SO3、KHSO3的物质的量相等,最终得到溶液为氯化钾溶液,设K2SO3、KHSO3的物质的量均是x,则3x=0.075L×0.1mol/L,解得x=0.0025mol,所以产生二氧化硫的体积是2×0.0025mol×22.4L/mol=0.0112L=112mL;
②根据图像中的数据可知,生成气体消耗的盐酸的体积小于无气体产生消耗的盐酸的体积,说明溶液中的溶质为KOH、K2SO3;
③根据A曲线的结果可知K2SO3、KHSO3的物质的量均是0.0025mol,则K元素的物质的量是3×0.0025mol=0.0075mol,所以原KOH溶液的物质的量浓度为0.0075mol/0.05L=0.15mol/L。
考点:考查二氧化硫与氢氧化钾溶液反应的判断,产物的分析,对图像的分析判断及计算
本题难度:一般
3、选择题 下列说法中正确的是
A.1mol/L的NaCl溶液是指此溶液中含有1mol NaCl
B.从1 L 0.5 mol/L,的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 mol/L,
C.25℃、1atm时,1molCl2的体积约为22.4L
D.50ml、l mol/L的CaCl2溶液和100ml、2 mol/L的NaCl溶液中的Cl-的物质的量浓度相同.
参考答案:D
本题解析:略
本题难度:一般
4、选择题 下列说法中,正确的是 ( )
A.22.4 L N2含阿伏加德罗常数个氮分子
B.在标准状况下,22.4 L水的质量约为18g
C.22 g二氧化碳与标况下11.2 L HCl含有相同的分子数
D.标准状况下,相同体积的任何气体单质所含的原子数相同
参考答案:C
本题解析:略
本题难度:一般
5、填空题 (4分)已知CO和CO2的混合气体14.4g,在标准状况下所占的体积为8.96L。则该混合气体中,CO的质量为?????????g,CO2的物质的量为???????????mol。
参考答案:(4分)??? 5.6????? 0.2
本题解析:设混合气中CO和CO2的物质的量分别是x和y,则28x+44y=14.4g,x+y=8.96L÷22.4L/mol=0.4mol,解得x=y=0.2mol,所以CO的质量是0.2mol×28g/mol=5.6g。
本题难度:一般