微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (8分)氢能是21世纪极具开发前景的新能源之一,
它既是绿色能源,又 可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的
可循环利用。请在下图的两个空框中填上循环过程中反应物和生成物的 分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是??????能转化为????????????能。
分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在)。从能量转移的角度看,过程Ⅱ主要是??????能转化为????????????能。
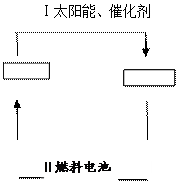
如果用KOH溶液作为电解质溶液,写出该燃料电池的电极反应式
负极:______________________________??正极:_________________________________。
参考答案:
 本题解析:略
本题解析:略
本题难度:一般
2、填空题 锌钡白是BaSO4和ZnS的混合物,ZnS难溶于水。某化工厂用重晶石为原料制备锌钡白,生产过程中会产生大量废气(主要成分为CO2、CO及少量SO2和硫蒸气等),为防止污染空气并提高原料利用率,生产中采用下述工艺流程:
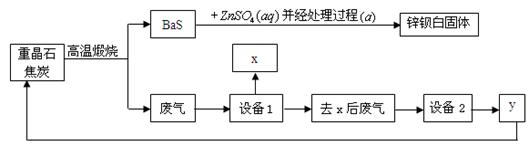
请根据上述流程回答下列问题:
(1)重晶石的化学式为_________,锌钡白可用于调制_______色和浅色油漆。
(2)处理过程(a)的步骤为:①_____________;②洗涤;③______________。
(3)设备1是冷却分离塔,若设备1前面的导气管过长、过窄,可能使导气管堵塞,其原因是????????????????????????????????????????????。
(4)设备2中所用的洗涤剂是NaOH溶液,则y的化学式为????????。写出设备2中发生反应的离子方程式: _____________________、_____________。
(5)可用??????法分离溶液中的钠盐,进行分离前,需要查得的是?????????????????
????????。(数据)
(6)制备过程中得到的硫磺,除了可用来制硫酸外,其它的用途为????????(至少写一种)。
参考答案:(1)BaSO4?, 白 (各1分,共2分)????(2)①
本题解析:略
本题难度:一般
3、填空题 废弃物的综合利用既有利于节约资源,又有利于保护环境。实验室利用废旧黄铜(Cu、Zn合金,含少量杂质Fe)制备胆矾晶体(CuSO4·5H2O)及副产物ZnO。制备流程图如下:
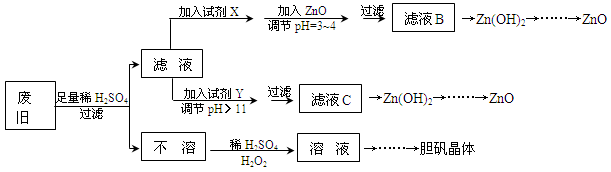
已知:Zn及化合物的性质与Al及化合物的性质相似,pH>11时Zn(OH)2能溶于NaOH溶液生成[Zn(OH)4]2-。下表列出了几种离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
?
| Fe3+
| Fe2+
| Zn2+
|
开始沉淀的pH
| 1.1
| 5.8
| 5.9
|
沉淀完全的pH
| 3.0
| 8.8
| 8.9
?
请回答下列问题:
(1)试剂X可能是__________,其作用是____________________。
(2)加入ZnO调节pH=3~4的目的是____________________。
(3)由不溶物生成溶液D的化学方程式为______________________________。
(4)由溶液D制胆矾晶体包含的主要操作步骤是______________________________。
(5)下列试剂可作为Y试剂的是______。
A.ZnO? B.NaOH C.Na2CO3??? D.ZnSO4
若在滤液C中逐滴加入盐酸直到过量,则产生的现象是______________________________。
(6)测定胆矾晶体的纯度(不含能与I-发生反应的氧化性杂质):准确称取0.5000g胆矾晶体置于锥形瓶中,加适量水溶解,再加入过量KI,用0.1000mol·L-1Na2S2O3标准溶液滴定至终点,消耗Na2S2O3标准溶液19.40mL。已知:上述滴定过程中的离子方程式如下:
2Cu2++4I-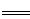 2CuI(白色)↓+I2,I2+2S2O32- 2CuI(白色)↓+I2,I2+2S2O32- 2I-+S4O62- 2I-+S4O62-
①胆矾晶体的纯度为_______________。
②在滴定过程中剧烈摇动(溶液不外溅)锥形瓶,则所测得的纯度将会__________(填“偏高”、“偏低”或“不变”)。
参考答案:(1)H2O2(新制氯水等氧化剂,其它合理答案也给分)(1分
本题解析:
试题分析:(1)废旧黄铜加足量稀硫酸,过滤,滤液中含有Fe2+、Fe3+、Zn2+,不溶物是铜。试剂X的作用是将Fe2+氧化成Fe3+,所以选择绿色氧化剂双氧水。
(2)加入ZnO调节pH=3~4的目的是与H+反应,降低H+浓度,促使Fe3+彻底水解生成 Fe(OH)3沉淀而除去;
(3)根据不溶物是铜,目的是制备胆矾,写出方程式Cu+H2O2+H2SO4 =CuSO4+2H2O;
(4)从溶液中分离出硫酸铜晶体应为蒸发浓缩、冷却结晶、抽滤;
(5)因为pH>11,Y
本题难度:一般
4、填空题 碳酸锂广泛应用于陶瓷和医药等领域,以锂辉石(主要成分为LiAlSi2O6)为原材料制备Li2CO3的工艺流程如下:
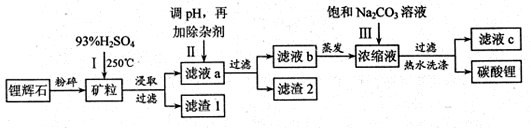
已知①2LiAlSi2O6+H2SO4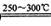 Li2SO4+Al2O3·4SiO2?H2O Li2SO4+Al2O3·4SiO2?H2O
②Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的PH分别为3.2、4.7、9.0和11.1
③某些物质的溶解度(S)如下表

请回答下列问题:
(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒的目的是????????????????。
(2)滤液a中含有Li+、SO42-,另含有Fe3+、Al3+、Fe2+、 Mg2+ ?、Ca2+?、Na+等杂质,步骤Ⅱ需在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时沉淀的杂质离子有????????????;石灰石调节溶液PH的原理的离子方程式为???????????????????????。
(3)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子方程式为?????????????????????????????????。
(4)步骤Ⅲ中加入饱和Na2CO3溶液过滤后需要用热水洗涤的原因是????????????????。
(5)从滤液c中可回收的主要物质是????????????????。
参考答案:(1)增大锂辉石与硫酸的接触面积,加快浸出反应速率,提高浸出
本题解析:
试题分析:(1)锂辉石用浓硫酸浸取之前要粉碎成细颗粒可以扩大与硫酸的接触面积,加快浸出反应速率,提高浸出率。(2)在搅拌下加入石灰石以调节溶液的PH到6.0—6.5,此时因为Fe3+、Al3+完全形成氢氧化物沉淀时,溶液的PH分别为3.2、4.7,其它的PH值都大于 6.0—6.5。故此时沉淀的杂质离子有Al3+、Fe3+?。石灰石调节溶液PH的原理的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑。(3)加入双氧水能把亚铁离子氧化成铁离子,反应的离子方程式为:2Fe2++H2O2+2H
本题难度:困难
5、填空题 (12分)综合利用海水可以制备食盐、纯碱、金属镁、溴等物质,其流程如下图所示:
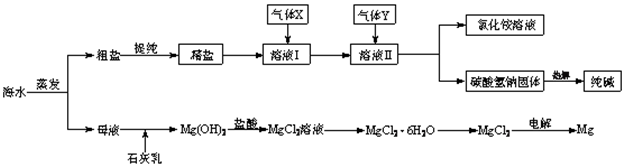
(1)粗盐中含有硫酸钠、氯化镁、氯化钙等可溶性杂质,为除去这些杂质而得精盐,进行如下操作:①溶解;②加过量的BaCl2溶液;③加过量的NaOH溶液;④加过量的Na2CO3溶液;⑤ ;⑥加适量的盐酸;⑦ 。
(2)溶液Ⅱ中发生反应的化学方程式是: 。
(3)Mg(OH)2沉淀中因混有Ca(OH)2,可选用___ ___ 溶液进行洗涤以除之。
(4)高温灼烧六水合氯化镁晶体(MgCl2·6H2O)所得固体是氧化镁,试写出该反应的化学方程式________ __ 。
(5)若在母液中通入氯气可提取海水中的溴,反应的离子方程式为:_____????_______。
参考答案:(1)过滤?????蒸发结晶(只写“蒸发”给分,只写“结晶”
本题解析:(1)考查粗盐的提纯加入碳酸钠溶液之后,溶液中含有硫酸钡、氢氧化镁和碳酸钡以及碳酸钙沉淀,需要通过过滤除去。酸化后通过蒸发结晶即得到氯化钠。
(2)根据生成物碳酸氢钠和氯化铵可知,反应的方程式为NaCl + NH3 + CO2 + H2O=NaHCO3 + NH4Cl,
(3)由于氢氧化镁的溶解度小于氢氧化钙的,所以要除去氢氧化镁中的氢氧化钙,可以加入氯化镁生成氢氧化镁和氯化钙而除去。
(4)氯化镁在溶液中存在水解平衡,水解是吸热的,所以直接加热得不到氯化镁,而是得到氧化镁,方程式为Mg
本题难度:一般
|