微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (16分)甲醇又称“木醇”或“木精”,沸点64.7℃,是无色有酒精气味易挥发的液体。甲醇有毒,误饮5~10mL能双目失明,大量饮用会导致死亡。甲醇是重要的化学工业基础原料和液体燃料,可用于制造甲醛和农药,并常用作有机物的萃取剂和酒精的变性剂等。
(1)工业上可利用CO2和H2生产甲醇,方程式如下:
CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1
又查资料得知:①CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1
CO2(g)+2H2(g)△H=Q2kJ·mol-1
②H2O(g)=H2O(l) △H= Q3kJ·mol-1,则表示甲醇的燃烧热的热化学方程式为 。
(2)工业上可用CO和H2O (g) 来合成CO2和H2,再利用(1)中反应原理合成甲醇。某温度下,将1molCO和1.5molH2O充入10L固定密闭容器中进行化学反应:CO(g)+H2O(g) CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
CO2(g)+H2(g) △H>0,当反应进行到10min时达到平衡,此时测得H2为0.6 mol。回答下列问题:
①0~10min内H2O(g)的平均反应速率为 。
②若想加快正反应速率的同时提高CO的转化率,可以采用的方法是 。
a.升高温度 b.缩小容器的体积
c.增大H2O (g)的浓度 d.加入适当的催化剂
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),重新达到化学平衡状态时,此时平衡混合气体中H2的体积分数为 。
(3)甲醇燃料电池是符合绿色化学理念的新型燃料电池,下图是以甲醇燃料电池(甲池)为电源的电解装置。已知:A、B、C、D、E、F都是惰性电极,丙中为0.1 mol/L CuSO4溶液 (假设反应前后溶液体积不变),当向甲池通入气体a和b时,D极附近呈红色。回答下列问题:
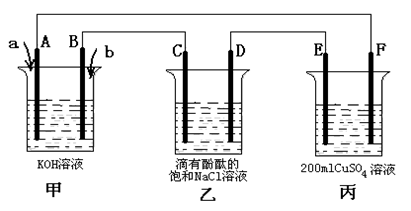
① a物质是 ,A电极的电极反应式为 。
② 乙装置中的总化学反应方程式为 。
③ 当乙装置中C电极收集到224mL(标况下)气体时, 丙中溶液的pH= 。
参考答案:(16分)(每空2分)(1)CH3OH(l)+3/2 O2(
本题解析:
试题分析:(1)已知反应:① CO2(g)+3H2(g) CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g)
CH3OH(l)+H2O (g) △H=Q1kJ·mol-1,② CH3OH(l)+1/2 O2(g) CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
CO2(g)+2H2(g)△H=Q2kJ·mol-1,③ H2O(g)=H2O(l) △H= Q3kJ·mol-1,则根据盖斯定律可知2×①+3×②+2×③即可得到甲醇的燃烧热的热化学方程式为CH3OH(l)+3/2 O2(g) = CO2(g)+2H2O(l) ΔH=(2Q1+3Q2+2Q3)kJ/mol。
(2)①当反应进行到10min时达到平衡,此时测得H2为0.6 mol,则根据方程式可知消耗水蒸气是0.6mol,水蒸气浓度变化量是0.6mol÷10L=0.06mol/L,实验用氢气表示的反应速率为0.06mol/L÷10min=6×10-3 mol·L-1·min-1。
②a.正方应是吸热反应,则升高温度反应速率加快,平衡向正反应方向进行,CO的转化增大,a正确; b.反应前后体积不变,则缩小容器的体积压强增大,反应速率较加快,淡平衡不移动,CO转化率不变,b错误;c.增大H2O (g)的浓度正反应速率增大,平衡向正反应方向进行,则CO转化率增大,c正确; d.加入适当的催化剂反应速率加快,但平衡不移动,CO转化率不变,d错误,答案选ac。
③若保持温度容积不变再向其中充入1molCO和0.5molH2O(g),由于温度不变,则平衡常数不变,所以
CO(g)+H2O(g) CO2(g)+H2(g)
CO2(g)+H2(g)
起始浓度(mol/L) 0.2 0.2 0 0
转化浓度(mol/L) x x x x
破坏你的(mol/L) 0.2-x 0.2-x x x
所以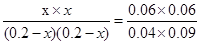
解得x=0.1
所以此时平衡混合气体中H2的体积分数为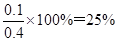
(3)①D极附近呈红色,这说明D电极周围产生氢氧根离子,即D电极是阴极氢离子放电,则A是负极。原电池中负极失去电子,则A通入的物质是CH3OH,电解质是氢氧化钾,则负极电极反应式为CH3OH - 6e- + 8OH-=CO32- + 6H2O。
②乙装置是电解饱和食盐水,则电解的总反应式为2NaCl + 2H2O  2NaOH + Cl2↑+ H2↑。
2NaOH + Cl2↑+ H2↑。
③当乙装置中C电极是阳极,氯离子放电生成氯气,如果收集到224mL(标况下)气体即氯气是0.01mol,则转移0.02mol电子,所以根据电子转移守恒可知丙装置中产生0.02mol氢离子,氢离子浓度是0.02mol÷0.2L=0.1mol/L,则丙中溶液的pH=1。
考点:考查盖斯定律应用、反应速率、平衡常数计算与应用、外界条件对平衡状态的影响以及电化学原理的应用等
本题难度:困难
2、选择题 下列有关阿伏加德罗常数说法正确的组合是
①标准状况下,22.4L氯气与足量的热NaOH溶液反应,转移电子数目为NA
②25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-数目为0.2 NA
③电解精炼铜时,若阳极质量减少64g,则转移到阴极的电子数不一定等于2NA
④标准状况下,33.6L氟化氢含有氟原子的数目为1.5NA
⑤2.24LCO2和2.8gN2组成的混合物中质子数为2.8 NA
⑥14gN60(分子空间结构类似C60)中含有的N—N键数目为1.5 NA
A.③⑥
B.①③⑥
C.①③④⑥
D.①②⑤⑥
参考答案:A
本题解析:
试题分析:①标准状况下,22.4L氯气物质的量为1mol,氯气与足量的热NaOH溶液反应为:Cl2+6NaOH=NaClO3+5NaCl+,可知电子转移的对应关系为:Cl2~5e?,则转移电子数目为5NA,错误;②25℃时,pH=13的1.0 L的Ba(OH)2溶液中含有的OH-物质的量为1.0L×0.1mol?L?1=0.1mol,则OH-数目为0.1 NA,错误;③电解精炼铜时,阳极上Cu,少量Zn、Fe发生失电子反应,所以阳极质量减少64g,则转移到阴极的电子数不一定等于2NA,正确;④因为氟化氢的沸点是19.54℃,在标准状况下是液体,不能用22.4L/mol换算,错误;⑤没有指明是否为标准状况,无法求算2.24L CO2物质的量,错误;⑥每个N原子与其它N原子形成3个N—N,根据均摊法,每个N原子均摊1.5个N—N键,14gN60N原子物质的量为1mol,则含有的N—N键数目为1.5 NA,正确,故答案为A。
考点:本题考查阿伏加德罗常数的计算。
本题难度:一般
3、实验题 工业上以黄铜矿为原料,采用火法熔炼工艺生产粗钢。
(1)该工艺的中间过程会发生反应:2Cu2O+Cu2S 6Cu+SO2↑,反应的氧化剂是?????????。
6Cu+SO2↑,反应的氧化剂是?????????。
(2)火法熔炼的粗铜含杂质较多。某化学研究性学习小组在实验室条件下用CuSO4溶液作电解液来实现粗铜的提纯,并对电解后溶液进行净化除杂和含量测定。
实验一 粗铜的提纯粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应),电解时粗铜应与电源的????????极相连,阴极上的电极反应式为??????????????。
实验二 电解后溶液的净化除杂在精炼铜的过程中,电解液中c(Cu2+)逐渐下降,c(Fe2+)、c(Zn2+)会逐渐增大,所以需定时除去其中的Fe2+、Zn2+。甲同学参考下表的数据,设计了如下方案:

试剂a是???????????????(填化学式),其目的是?????????????;该方案能够除去的杂质离子是???????????(填离子符号)。
实验三 电解后溶液离子含量的测定
乙同学设计了如下方案:
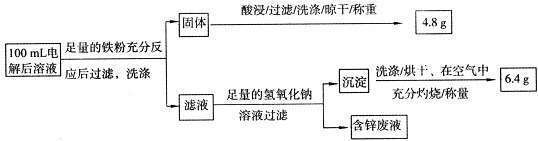
则100mL溶液中Cu2+的浓度为?????????mol·L-1,Fe2+的浓度为?????????mol·L-1。
参考答案:(14分)
(1)Cu2O 、Cu2S (2分);<
本题解析:
试题分析:
(1)反应中Cu2O 、Cu2S的Cu均从+1→0价,所以反应的氧化剂Cu2O 、Cu2S。
(2)精炼铜时粗铜做阳极与电源的正极相连,电极反应:Cu2++2e-= Cu。根据流程中调节pH到4可知三价铁沉淀,试剂a是氧化剂,将Fe2+氧化成Fe3+,除去Fe2+。固体为铁和铜的混合物,酸处理后的4.8g为铜,n(Cu)=4.8/64g/mol=0.075mol,c(Cu2+)=0.75 mol·L-1;根据题意生成m(Fe2O3)=6.4g,n(Fe2O3)=6.4g/
本题难度:困难
4、选择题 下列叙述正确的是[???? ]
A.电镀时应把镀件置于电解槽的阳极
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.目前已经研制成功铝-空气电池,铝为电池的负极
D.原电池的负极和电解池的阳极所发生的反应同属还原反应
参考答案:C
本题解析:
本题难度:一般
5、选择题 市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li+2Li0.35NiO2 2Li0.85NiO2。下列说法不正确的是 [???? ]
2Li0.85NiO2。下列说法不正确的是 [???? ]
A.放电时,负极的电极反应式:Li-e-==Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质
D.放电过程中Li+向负极移动
参考答案:D
本题解析:
本题难度:一般