微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 血红蛋白的相对分子质量约为68000,已知其中含铁的质量分数为0.33%,则平均每个血红蛋白的分子中铁原子数约为????????????????????????????????????(?????)
A.5
B.4
C.3
D.2.408×1024
参考答案:D
本题解析:略
本题难度:一般
2、计算题 (10分)将54.4 g铁粉和氧化铁的混合物中加入200 mL的稀硫酸,恰好完全反应,放出氢气4.48 L(标准状况).反应后的溶液中滴加KSCN不显红色,且无固体剩余物,求:⑴.混合物铁和氧化铁各是多少克?⑵.原稀硫酸物质的量浓度?⑶.反应后得到FeSO4的物质的量是多少?
参考答案:
⑴.设铁粉的物质的量为x,氧化铁的物质的量为y。
本题解析:
试题分析:
由题意可知:(1)Fe2O3+6H+=2Fe3++3H2O、(2)Fe+2Fe3+=3Fe2+、(3)Fe+H2SO4=FeSO4+H2↑,要满足题意,铁粉一部分和三价铁离子反应,一部分和硫酸反应;所以设铁粉的物质的量为x,质量为56x,氧化铁的物质的量为y,其质量为160y,得到第一个方程程式:56x+160y=54.4g,由方程式(2)可知,与硫酸反应的铁粉的物质的量为x-y,同时由生成的H2标况下的体为22.4L可知,x-y="22.4L/22.4L·mol=0.2mol
本题难度:困难
3、选择题 久置于空气中的下列物质,因被氧化而呈黄色的是
A.浓硝酸
B.氯化亚铁溶液
C.溴苯
D.溴化银
参考答案:B
本题解析:硝酸不稳定,在空气中分解(被还原成NO2)生成NO2,生成的NO2溶于其中显黄色;Fe2+不稳定,在空气中被氧气氧化成Fe3+而显黄色,苯酚在空气中不稳定,氧化后显粉红色,而溴苯无此现象;溴化银不稳定,分解后显黑色,其原因是溴化银被还原生成了银粉末。
本题难度:简单
4、选择题 15g铁粉和氧化铁的混合物,放入150mL稀H2SO4中,发现固体完全溶解,并放出1.68L H2(标准状况),加入KSCN溶液后,无颜色变化。为了使Fe2+完全转化为Fe(OH)2沉淀,共耗用200mL 3 mol/L NaOH溶液,则原硫酸溶液的物质的量浓度为
A.4 mol·L—1
B.3 mol·L—1
C.2 mol·L—1
D.1 mol·L—1
参考答案:C
本题解析:
试题分析:当溶液中的亚铁离子全部转化为沉淀时,留在溶液中的就只有硫酸钠,则根据氢氧化钠的物质的量是0.2L×3mol/L=0.6mol并结合钠离子守恒可知,生成硫酸钠的物质的量是0.6mol÷2=0.3mol。因此根据S原子守恒可知,原硫酸的物质的量是0.3mol,则浓度=0.3mol÷0.15L=2mol/L,答案选C。
本题难度:一般
5、简答题 工业上用铝土矿(主要成分是A1203,还有少量的Fe203,SiO2)提取冶炼铝的原料氧化铝.工艺流程图如图:
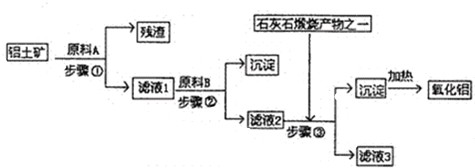
(1)原料A的名称是______,步骤①反应的离子方程式是______.
(2)滤液1中要加入稍过量原料B,原料B的化学式是______.步骤②反应的离子方程式是:______.
(3)步骤③的离子化学方程式是:______.
(4)步骤①②③的操作都是______(填操作名称),要检验Al(OH)?3沉淀是否完全的方法是______.
(5)如果省去步骤①,即溶解铝土矿是从加入原料B开始,则会对氧化铝的提取有什么影响?______.
参考答案:由工艺流程可知步骤③通入的为二氧化碳,生成的沉淀为氢氧化铝,
本题解析:
本题难度:一般