微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
步骤
| 操作
| 现象
|
Ⅰ
| 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液
| 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出
(1)常温下,FeCl3溶液的pH_______7(填“<”、“>”或“=”)。
(2)分析红褐色产生的原因。
① 甲同学认为步骤I中溶液呈红褐色是因为生成了Fe(OH)3,请用化学平衡移动原理解释溶液呈红褐色的原因:________。
② 乙同学认为可能是发生了氧化还原反应,其中Fe3+ →Fe2+ ;请写出Fe3+ 跟SO32-反应的离子方程式
______________。
乙同学查阅资料得知:
1.Fe2+与SO32-反应生成墨绿色的絮状沉淀FeSO3;
2.墨绿色的FeSO3与黄色的FeCl3溶液混合后,溶液呈红褐色。
(3)甲同学为了确认溶液呈红褐色的原因是生成了Fe(OH)3,设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅱ
| 用激光笔照射步骤I中的红褐色溶液
| 出现“丁达尔效应”
甲同学因此得出结论:溶液呈红褐色是因为生成了Fe(OH)3。而乙同学认为甲同学得出结论的证据仍然不足,乙同学的理由是________。
(4)为进一步确认Na2SO3溶液与FeCl3溶液反应的情况,乙同学设计并完成了如下实验:
步骤
| 操作
| 现象
| Ⅲ
| 向1 mol?L-1的FeCl3溶液中通入一定量的SO2
| 溶液由黄色变为红褐色
| Ⅳ
| 用激光笔照射步骤Ⅲ中的红褐色溶液
| 没有出现“丁达尔效应”
① 经检验步骤Ⅲ中红褐色溶液含有Fe2+,检验Fe2+选用的试剂是_________(填字母)。
a.K3[Fe(CN)6] 溶液?????????b.KSCN溶液????????c.KMnO4溶液
② 请用离子方程式和必要的文字说明步骤Ⅲ中出现红褐色的原因???????。
(5)结论:由上述实验得知,甲、乙两同学所持观点均正确。
参考答案:(1)<(1分) (2) ① Fe3++3H2O![]()
本题解析:
试题分析:(1)氯化铁是强酸弱碱盐,铁离子水解溶液显酸性,因此常温下,FeCl3溶液的pH<7。
(2)① 在氯化铁溶液中存在铁离子的水解平衡:Fe3++3H2O Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。 Fe(OH)3+3H+,加入Na2SO3后,消耗氢离子,溶液中c(H+)下降,平衡正向移动,生成Fe(OH)3。
②铁离子具有氧化
本题难度:一般
2、计算题 用黄铜矿炼铜按反应物和生成物可将总反应可以写成:
CuFeS2 + SiO2 + O2→ Cu + FeSiO3 + SO2
事实上冶炼反应是分步进行的。(1)黄铜矿在氧气作用下生成硫化亚铜和硫化亚铁;(2)硫化亚铁在氧气作用下生成氧化亚铁,并与二氧化硅反应生成矿渣;(3)硫化亚铜与氧气反应生成氧化亚铜;(4)硫化亚铜与氧化亚铜反应生成铜。
1)??写出上述各个分步反应(1,2,3,4)的化学方程式。
2)??给出总反应方程式的系数。
3)??据最新报道, 有一种叫Thibacillus ferroxidans的细菌在氧气存在下可以将黄铜矿氧化成硫酸盐。反应是在酸性溶液中发生的。试写出配平的化学方程式。
4)??最近我国学者发现,以精CuFeS2矿为原料在沸腾炉中和O2 (空气)反应, 生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,成本降低了许多。实验结果如下:
沸腾炉温度/℃
| 560
| 580
| 600
| 620
| 640
| 660
| 生
成
物
| 水溶性Cu/%
| 90.12
| 91.24
| 93.50
| 92.38
| 89.96
| 84.23
| 酸溶性Cu/%
| 92.00
| 93.60
| 97.08
| 97.82
| 98.16
| 98.19
| 酸溶性Fe/%
| 8.56
| 6.72
| 3.46
| 2.78
| 2.37
| 2.28
回答如下问题:
(1) ?CuFeS2和O2主要反应的方程式为:
(2) ?实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) ?温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
参考答案:(1)2CuFeS2 + O2 =Cu2S + 2FeS +
本题解析:本题由三个相互独立的问题组成,可以认为是三个题,占总分的较大比例,但由于都是有关黄铜矿的利用问题,因而被编在一起,而且多少相互之间可以起到“条件不同反应不同”的关联作用。与前两题相比,本题的第一部分比较简单,好像是命题人考虑着对前面的试题可能解答得不好的学生起一点安抚鼓励作用。写四个分步反应的方程式的考核点只是把题面的表述转换成化学方程式,但题面并没有指出生成物中的硫的形态。根据中学化学知识,可以想见它是SO2,大多数学生应该不会写错。其中第四个反应就是所谓“冰铜”反应,比较特殊,但试题已经告诉大家反应产
本题难度:一般
3、选择题 下列反应的离子方程式正确的是(???)
A.硫酸铁溶液与氢氧化钡溶液反应:Fe3++3OH-====Fe(OH)3↓
B.硫化钠溶液与氯化铁溶液反应:2Fe3++3S2-====Fe2S3
C.过量的铁与很稀的硝酸溶液反应无气体放出:4Fe+10H++ ====4Fe2++3H2O+ ====4Fe2++3H2O+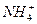
D.硫化氢气体通入氯化亚铁溶液:H2S+Fe2+====FeS↓+2H+
参考答案:C
本题解析:A选项中缺少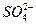 与Ba2+起反应的离子方程式。 与Ba2+起反应的离子方程式。
B选项中Fe3+与S2-发生氧化还原反应,离子方程式为2Fe3++S2-====2Fe2++S↓。
C选项中无气体放出,说明 本题难度:简单 本题难度:简单
4、选择题 纳米是长度单位,l nm="10" -9m,当物质的颗粒达到纳米级时,会具有一些特殊的性质。例如由铜制成“纳米铜”具有非常强的化学活性,在空气中可以燃烧。下列关于“纳米铜"的叙述正确的是
A.“纳米铜”比铜片的金属性强
B.“纳 米铜”比铜片更易失去电子 米铜”比铜片更易失去电子
C.“纳米铜"比铜片的氧化性强
D.“纳米铜”的还原性与铜片相同
参考答案:D
本题解析:略
本题难度:一般
5、选择题 向一定量的Cu、Fe2O3的混合物中加入300 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为?? ( )。
A.6.4 g
B.4.8 g
C.2.4 g
D.1.6 g
参考答案:C
本题解析:向混合物中加入盐酸时发生如下反应:Fe2O3+6HCl=2FeCl3+3H2O、2FeCl3+Cu=CuCl2+2FeCl2,由题意可知:Cu与Fe2O3的物质的量相等,设二者的物质的量均为x,则有6x=0.3 L×1 mol·L-1=0.3 mol,x=0.05 mol;若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量即为氧原子的质量:0.05 mol×3×16 g·mol-1=2.4 g。
本题难度:一般
|
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|