微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 将氢气通入10g灼热的氧化铜中,过一段时间后得到8.4g固体,下列说法正确的是( )
A.有8.4g铜生成
B.有8g氧化铜参加反应
C.有1.6g水生成
D.有10g氧化铜被还原
参考答案:B
本题解析:根据题意,10g氧化铜不一定全部参加反应,所以得到的8.4g固体也不一定都是铜的质量。我们可以利用“固体-固体”差量法解决此题。反应前后固体的质量差(10-8.4=1.6g)=参加反应的氧化铜的质量-生成的铜的质量=CuO-Cu,即理论上每80份质量的CuO参加反应转化为64份质量的Cu,固体质量减少16份,据此可列比例求解。
H2+CuO-Cu+H2O △m(固体质量减少)
80 64 18 80-64=16
x y z 10-8.4=1.6g
可以求出![]()
本题难度:简单
2、选择题 将14g铜银合金与足量的一定浓度的硝酸溶液反应,把放出的气体与标准状况下体积为1.12L的O2混合后再通入水中,恰好全部被吸收,则合金中铜的质量为
A.3.2g
B.4.8g
C.6.4g
D.10.8g
参考答案:A
本题解析:反应中合金失电子,氧气得电子,硝酸最终仍然是硝酸,可认为没有电子的得失
设铜银的物质的量分别为x、y,则64x+108y=14
由电子的得失守恒得:2x+y=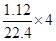
解得:x=0.05mol?? y=0.1mol
铅的质量为3.2g
本题难度:一般
3、填空题 铁单质及其化合物在生活、生产中应用广泛。请回答:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应是???????????????。
(2)由于氧化性Fe3+>Cu2+氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是???????????????????????????????????????。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是?????????????????(用离子方程式表示)。在使用时发现硫酸铁不能将酸性废水中的悬浮物沉降除去,其原因是??????????????????。
(4)磁铁矿是工业上冶炼铁的原料之一,其原理是Fe3O4十4CO 3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是????????????。
3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是????????????。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是??????(填字母)。
?
| 陈述Ⅰ
| 陈述Ⅱ
| 判断
|
A
| 铁是地壳中含量最高的金属元素
| 铁是人类最早使用的金属材料
| Ⅰ对;Ⅱ对;有
|
B
| 常温下铁与稀硫酸反应生成氢气
| 一定温度下氢气能还原氧化铁得到铁
| Ⅰ对;Ⅱ对;无
|
C
| 铁属于过渡元素
| 铁和铁的某些化合物可用作催化剂
| Ⅰ错;Ⅱ对;无
|
D
| 在空气中铁表面形成致密氧化膜
| 铁不能与氧气反应
| Ⅰ对;Ⅱ对;有
?
参考答案:(1)O2+2H2O+4e-=4OH-(2分)
(2)
本题解析:
试题分析:(1)在钢铁的吸氧腐蚀中,正极上发生的是氧气得电子的还原反应,即O2+2H2O+4e-=4OH-,
(2)三价铁的氧化性强于铜离子,所以金属铜可以和三价铁之间发生氧化还原反应:Cu+2Fe3+=2Fe2++Cu2+,
(3)三价铁水解生成的氢氧化铁胶体具有净水作用,原理方程式为:Fe3++3H2O?Fe(OH)3+3H+,硫酸铁中由于三价铁水解导致溶液显酸性,而酸性环境中,氢离子抑制了铁离子的水解,无法生成氢氧化铁胶体,所以硫酸铁不能使酸性废水中的悬浮物沉降而除去,
(
本题难度:一般
4、填空题 (12分)工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:

(1)在废渣溶解时需要使用酸,应选用__________,为了提高废渣的浸取率,可采用的措施有哪些?
_____________________________________________________________(至少写出两点)。
(2)物质A是一种氧化剂,工业上最好选用_____________(供选择使用的有:空气、Cl2、MnO2),其理由是????????????????????????????????????????????????(至少写出两点)。
(3)“结晶”反应的化学方程式为__________________________________________________。
(4)上述生产流程中多处采用了过滤操作,实验室中完成相应的操作需要用到的玻璃仪器有烧杯及____________________________________________。
参考答案:(1)硫酸,将废渣粉碎、加热、搅拌等。??
(2)空气
本题解析:
试题分析:通过流程图可以看出生成的是硫酸盐,所以溶解废渣时要用硫酸。从影响速率的因素考虑应该采用废渣粉碎、加热、搅拌等方法。空气是一种最廉价且无污染的氧化剂,所以选空气。根据图示可知,结晶过程发生的反应为3Fe2(SO4)3+12NH3·H2O=(NH4)2Fe6(SO4)4(OH)12↓+5(NH4)2SO4。过滤操作总需要用到的玻璃仪器有烧杯、玻璃棒和漏斗。
点评:近几年,工艺流程题已成为各地高考的热点试题,其具有阅读量大、信息新颖、情境陌生、流程复杂等特点。考生对此往往就会有畏惧感,解
本题难度:一般
5、选择题 某合金(仅含铜、 铁)中铜和铁的物质的量之和为ymol,其中Cu的物质的量分数为a ,将其全部投入100mLbmol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:
A.b≥40y(2-)
B.b≥8 0y(2-) 0y(2-)
C.b≥40y(1-)
D.b≥80y(1-)
参考答案:C
本题解析:略
本题难度:一般
|