微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (5分)25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L溶液。
(1)该溶液中共含有________种不同的微粒(包括分子和离子);
(2)在这些微粒中,__________和__________两种微粒的物质的量之和等于0.01mol;
(3)________和___________两种微粒的物质的量之和比H+的物质的量多0.008mol。
2、选择题 下列说法中,不正确的是(???)
A.在NaAlO2溶液中,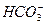 不可能大量存在
不可能大量存在
B.在0.1 mol·L-1的氢溴酸中加入适量的蒸馏水,溶液的c(H+)减小
C.在由水电离出的c(OH-)=1×10-12 mol·L-1的溶液中,Al3+不可能大量存在
D.室温下pH=6的酸性溶液中,可能存在NH3·H2O分子
3、实验题 硫酸亚锡(SnSO4)是一种重要的硫酸盐,主要用于电镀工业的镀锡、铝合金表面的氧化着色、印染工业的媒染剂、双氧水去除剂等。某研究小组设计SnSO4制备路线如下:
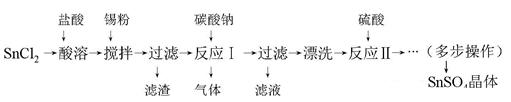
查阅资料:
Ⅰ.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
Ⅱ.SnCl2易水解生成难溶物Sn(OH)Cl(碱式氯化亚锡)。
请回答下列问题:
(1)SnCl2粉末需加浓盐酸进行溶解,请用平衡移动原理解释原因?????????????????。
(2)加入Sn粉的作用有两个:①调节溶液pH?②??????????????????????。
(3)反应Ⅰ生成的气体为CO2,得到的沉淀是SnO。该沉淀经过滤后需漂洗,如何证明沉淀已经洗涤完全? ????????????????????????????????????????????????????????。
(4)多步操作包含的具体实验步骤的名称可以是:??????????????????????????????????。
(5)酸性条件下,SnSO4还可以用作双氧水去除剂,发生反应的离子方程式是???????。
(6)该小组通过下列方法测所用锡粉样品的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn + 2HCl→SnCl2 + H2↑;
②加入过量的FeCl3;
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2 + K2Cr2O7 + 14HCl →6FeCl3 + 2KCl + 2CrCl3 +7H2O
取1. 226 g 锡粉样品,经上述各步反应后,共用去0.1000 mol/L K2Cr2O7溶液32.00 mL。则该锡粉样品中锡的质量分数是????????
4、选择题 (6分)常温下,浓度均为0.1mol·L-1的六种溶液的pH如下表:
溶质
| CH3COONa
| NaHCO3
| Na2CO3
| NaClO
| NaCN
| Na2SO4
|
pH
| 8.8
| 9.7
| 11.6
| 10.3
| 11.1
| 7.0
①上述盐溶液中的阴离子,结合质子能力最强的是 .
②根据表中数据,浓度均为0.01mol·L-1的下列五种物质的溶液中,酸性最强的
是 (填字母);将各溶液分别稀释100倍,pH变化最小的是 (填字母).
A.HCN??????? B.HClO????????????? C.H2SO4???????????? D.CH3COOH??? E.H2CO3
5、选择题 0.1 mol?L-1 KHCO3溶液中下列表达式不正确的是
A.c(K +)+c(H+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
B.c(K+)> c (HCO3-)> c(OH-)> c(CO32-)> c(H+)
C.c(HCO3-)+ c(CO32-)+ c(H2 CO3)=" 0.1" mol?L-1
D.c(K+)> c(HCO3-)> c(OH-)> c(H+)> c(CO32-)
|