微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 25℃时,某浓度的NH4Cl溶液pH = 4,下列叙述正确的是(??)
A.溶液中的 c(OH-)= 1×10-10 mol·L-1
B.溶液中的c(NH4+)>c(Cl-)>c(H+)>c(OH-)
C.溶液中的c(H+)+ c(NH4+)= c(Cl-)+ c(OH-)
D.溶液中的c(NH3·H2O)= c(NH4+)
参考答案:AC
本题解析:
试题分析:常温下,水的离子积Kw=1×10-14 ,因为溶液pH=4,所以可计算得c(OH-)= 1×10-10 mol·L-1 ,A正确;氯化铵水解呈酸性,所以不水解的离子大于水解离子,离子浓度大小顺序有c(Cl-)>c(NH4+)>c(H+)>c(OH-),B错误;根据电荷守恒,有c(H+)+ c(NH4+)= c(Cl-)+ c(OH-),C正确;NH3·H2O由NH4+ 微弱水解而来,所以c(NH3·H2O)< c(NH4+),D错误;故选AC。
本题难度:一般
2、选择题 在蒸发皿中加热蒸干并灼烧,下列物质的溶液,可以得到该固体物质的是
A.氯化铝
B.碳酸氢钠
C.高锰酸钾
D.硫酸铁
参考答案:D
本题解析:A错,热蒸干氯化铝溶液,铝离子会水解生成氢氧化铝,灼烧生成氧化铝;
B错,碳酸氢钠不稳定受热易分解为碳酸钠,加热后得到的固体为碳酸钠;
C错,高锰酸钾受热不稳定易分解为锰酸钾、二氧化锰。
D正确,硫酸铁溶液中虽然+3铁离子要发生水解,但水解后生成的氢氧化铁与硫酸会继续反应,最终得到硫酸铁固体。
本题难度:一般
3、选择题 将0.1mol下列物质置于1L水中,充分搅拌后,溶液中阴离子数最多的是:(????)
A.KCl
B.Mg(OH)2
C.Na2CO3
D.MgSO4
参考答案:C
本题解析:
试题分析:氢氧化镁难溶于水,阴离子数量最少。由于碳酸钠溶于水发生水解反应,方程式为CO32-+H2O HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
HCO3-+OH-,根据方程式可知,消耗1mol阴离子,产生2mol阴离子,所以C中最多。答案选C。
点评:本题主要考 查盐类水解的应用,但需要注意的就是如果固体难溶,则其离子在水溶液中一定最少。
本题难度:简单
4、选择题 常温下,向等物质的量浓度的两种一元酸的盐溶液中,分别通入少量的CO2,发生如下反应:NaA+CO2+H2O===HA+NaHCO3 2NaB+CO2+H2O===2HB+Na2CO3,则等物质的量浓度的HA和HB在水中电离出H+的能力大小关系是??? ( )
A.HA较强
B.HB较强
C.两者一样
D.无法比较
参考答案:A
本题解析:比较两钠盐与碳酸反应产物可知,NaA生成NaHCO3,而NaB得到的是Na2CO3,说明酸根离子B—相对A—更易结合H+,进而可知,HB相对电离出H+的能力差,其酸性相对较弱,HA酸性较强,故选A
本题难度:一般
5、填空题 (12分)
本题共有3个小题,回答有关问题:
(1)检验牙膏中含有甘油的试剂是????????????,实验现象???????????;有关反应的化学方程式??????????????????????????????????。
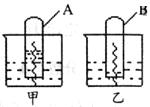
(2)在两烧杯中盛有甲、乙两种不同的稀溶液,用铁丝做电化腐蚀实验。实验进行一段时间后,A试管中液面高于烧杯中液面,B试管中液面低于烧杯中液面,试比较pH值大小:
甲?????乙(填“<”、“>”或“=”),并写出A中铁丝发生腐蚀时的电极反应式:负极???????,正极???????????。
(3)已知某溶液中只存在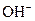 、H+、
、H+、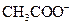 、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
、Na+四种离子,某同学推测其离子浓度大小顺序有如下四种关系:
I: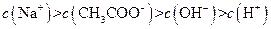
II: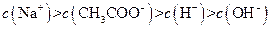
III: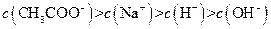
IV: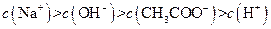
①若溶液中只溶解了一种溶质,则该溶质是?????????,上述四种离子浓度的大小顺序
为????????????(填编号)。
②若上述关系中III是正确的,则溶液中溶质为???????????????
③若该溶液是由体积相等的氢氧化钠溶液和醋酸溶液混合而成,且恰好呈中性,则混合前两溶液的物质的量浓度大小关系为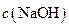 ???????
???????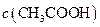 (填“<”、“>”或“=”),混合前
(填“<”、“>”或“=”),混合前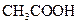 溶液中的
溶液中的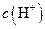 ??????????
??????????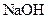 溶液中的
溶液中的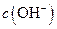 ?(填“<”、“>”或“=”)。
?(填“<”、“>”或“=”)。
参考答案:
(1)新制 本题解析:略
本题解析:略
本题难度:简单