微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。
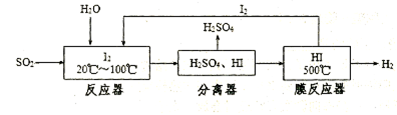
(1)该过程中能循环利用的物质为?????????。
(2)在该过程中,使用膜反应器及时分离出HI分解产生的H2,目的是???????????(用平衡移动的原理解释)。
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。已知浓硫酸的沸点为338℃,加热时酒灯火焰的温度为400℃~500℃。
①甲同学用装置I进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,请解释生成该白色沉淀的可能原因????????????????????????(用离子方程式表示)。
②乙同学认为甲同学的装置不完善,设计了改进装置II进行实验(夹持装置和A中加热装置已略,气密性已检查)。
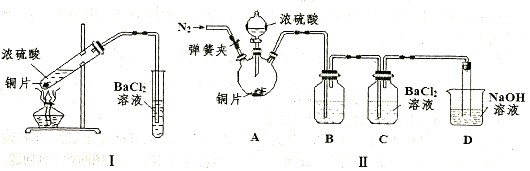
a.打开弹簧夹通入N2,一段时间后关闭弹簧夹;b.滴加一定量浓硫酸,加热A,一段时间后C中未见沉淀生成。操作a的目的是????????????????????????????,装置B中的剂是????????????????????。
③丙同学取乙实验后的C中溶液少许,滴加一种无色溶液,产生不溶于盐酸的白色沉淀,丙同学滴加的试剂可能是???????????(填字母编号)。
a.NaOH溶液??????? b.H2O2溶液???? c.新制氯水??????? d.酸性KmnO4溶液??
④装置D中与导管连接的是硬质玻璃管,则装置D的作用是???????????????????。
参考答案:
(1)I2?(2分)
(2)使平衡向正反应方向
本题解析:
试题分析:(1)由工艺流程可知能循环利用的物质为I2。(2)及时分离出HI分解产生的H2,使HI的分解平衡向正反应方向移动,提高了I2和H2的产率。(3)本小题首先抓住已知信息“浓硫酸的沸点为338 ℃,加热时酒精灯火焰的温度为400℃~500℃”,说明浓硫酸在温度较高时也能挥发出H2SO4蒸气。①白色沉淀应为BaSO4,可能原因有二:一是挥发出的H2SO4提供的SO42-与Ba2+反应生成,二是空气中O2的氧化所致。②操作a通入N2目的是排出装置中的O2。C中未见沉淀生成,说明B中的试剂能吸收挥发出的H2SO4且不产生新的杂质,还不能与SO2反应,故该试剂应是饱和NaHSO3溶液。③乙实验后的C中的溶液会溶有SO2,题中不溶于盐酸的白色沉淀应是BaSO4,滴加一种无色溶液, 只能是H2O2溶液。④装置D的作用是既能吸收未反应的SO2防止大气污染,又能防止NaOH溶液倒吸入装置C中影响实验结果。2的性质为载体的实验题,涉及化学平衡的移动原理的考查。
本题难度:一般
2、填空题 (6分)根据正放在桌面上的右图装置,回答下列问题:

(1)现有H2、SO2、NH3、N2?四种气体
①用排空气法收集某气体,则由A口进气可收集到的气体为?????????。
②用排水法收集某气体,可在该容器中充满水,气体应由????????口进入。
(2)若用该装置除去H2中的水分,容器中可盛放的试剂为?????????。
参考答案:(6分)(1)? ① SO2??? ② B?????????
本题解析:
试题分析:(1)①由A口进气,说明收集的气体密度大于空气的,因此是SO2。
②用排水法收集某气体,可在该容器中充满水,则气体应由B口进入,水从A排出。
(2)干燥氢气可以选择浓硫酸。
点评:常见气体的收集方法是:1.排水法,适用于不易溶于水的气体。例如氢气,氧气;2.向上排空气法,适用于比空气密度大,溶于水的气体,例如二氧化碳,氯气;3,向下排空气法,适用于比空气密度小,溶于水的气体,例如氨气。
本题难度:一般
3、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有 [???? ]
A.CO、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、Cl2、O2
参考答案:AC
本题解析:
本题难度:一般
4、选择题 下列有关实验室制取气体的反应中,其反应原理不属于氧化还原反应的是
A.实验室中用高锰酸钾加热分解制取 O2
B.实验室中用稀硫酸与锌粒反应制取 H2
C.实验室中用H2O2与MnO2作用产生O2
D.实验室中用稀盐酸与石灰石反应制取CO2
参考答案:D
本题解析:凡是有元素化合价升降的反应是氧化还原反应,所以选项A、B、C都是氧化还原反应。选项D是复分解反应,不是氧化还原反应,所以正确的答案选D。
本题难度:一般
5、填空题 (18分)某学生欲用已知物质的量浓度的氨水来测定未知物质的量浓度的盐酸溶液,请填写下列空白:
Ⅰ.(1)(6分)用标准的氨水溶液滴定盐酸溶液时,锥形瓶中应加入????????作指示剂, ___ ____手摇动锥形瓶,眼睛注视??????????????????????????????,滴定终点现象为:??????????????????????????????????????????????????????
(2)下列操作中可能使所测盐酸溶液的浓度数值偏低的是___???????(2分)??
A.酸式滴定管未用盐酸溶液润洗就直接注入盐酸溶液
B.滴定前盛放盐酸溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管尖嘴处在滴定前有气泡,滴定后气泡消失
D.读取氨水体积时,滴定开始时仰视读数,滴定结束时俯视读数
E. 滴定时标准液滴出锥形瓶外
Ⅱ. (10分)常温下,用0.2 mol·L-1氨水溶液滴定20ml盐酸溶液,随氨水滴加溶液PH变化如图所示,据图回答下列问题:
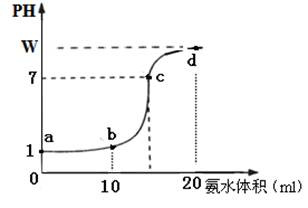
(1)该盐酸溶液的物质的量浓度为????????????。
(2)在c点溶液中所有离子浓度由大到小的顺序为:???????????????????
(3)若正确加入指示剂,滴定终点位于曲线??????????
A.d点????????? B.c点???????????? C.a、c之间????????????????? D.d点之后
(4)a、b、c三点处溶液中,水电离出的氢离子浓度由大到小顺序为???????????。
(用a、b、c表示)
(5)写出d点溶液中c(NH3·H2O)的精确表达式???????????????????????????????
mol·L-1??(混合溶液总体积等于两溶液体积之和)
参考答案:(18分)
Ⅰ.(1)(6分)甲基橙
本题解析:本题考查酸碱中和滴定和弱电解质电离的相关问题。Ⅰ、氨水滴定盐酸,终点生成强酸弱碱盐,水解呈酸性,故使用甲基橙做指示剂(3.1~4.4),终点现象为红色变为橙色,且半分钟不褪色;误差分析根据c(HCl)=?A、未润洗,导致HCl的稀释,浓度减小;B、锥形瓶未干燥,不影响;C、碱式滴定管先有气泡,后没有,是V(NH3·H2O)增大,c(HCl)偏大;D、先仰视、后俯视,使V(NH3·H2O)减小,c(HCl)偏小;E、有标准液洒出,使V(NH3·H2O)增大,c(HCl)偏大;故答案为AD。
Ⅱ、(1)看起点pH=1,说明c(H+)=0.1mol/L,故c(HCl)= 0.1mol/L;(2)c点pH=7,呈中性c(H+)=c(OH-),根据电荷 守恒c(NH)=c(Cl-);有c(NH)=c(Cl-)> c(H+)=c(OH-);(3)滴定终点,恰好反应生成NH4Cl,水解呈酸性,终点在b、c之间,答案为C;(4)a点,pH=1,水电离的c(H+)=10-13mol/L、b点HCl恰好中和,NH4Cl水解,水电离的c(H+)>10-7mol/L;c点呈中性,c(H+)=10-7mol/L,水电离的氢离子浓度由大到小为:b、c、a;(5)电荷守恒有:c(NH)+ c(H+)=c(Cl-)+c(OH-),c(NH)=c(Cl-)+c(OH-)- c(H+)=+10W-14-10-W,又由物料守恒有n(NH3·H2O)+ n(NH)="0.02" mol/L×0.02L,
c(NH3·H2O)==0.05+10-W-10W-14?? mol·L-1
本题难度:一般