微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)请填空:
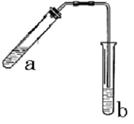
(1)试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的计入顺序操作是???????????????
(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是 ????????????????
(3)实验中加热试管a的目的是:
① ??????????????????????????② ????????????????????????????????????????????
(4)试管b中加有饱和Na2CO3溶液 ,其作用是???????????????????????????????????
(5)反应结束后,振荡试管b静置,观察到的现象是?????????????????????????????
参考答案:(1) 先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋
本题解析:
试题分析:(1)为防止酸液飞溅,应将密度大的液体加入到密度小的液体中,乙酸易挥发,冷却后再加入乙酸,
故答案为:先加入乙醇,然后边摇动试管边慢慢加入浓硫酸,再加冰醋酸;
(2)液体乙酸乙醇沸点低,加热要加碎瓷片,防止暴沸,故答案为:在试管a中加入几粒沸石(或碎瓷片);
(3)实验中加热试管,反应的温度高,反应速度快,该反应为可逆反应,温度高,乙酸乙酯的沸点低,易挥发,所以化学平衡向正反应方向移动,利于生成乙酸乙酯,
故答案为:加快反应速率;及时将产物乙酸乙酯蒸出,以利于平衡向生成乙酸乙酯的方向移动;
(4)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯,
故答案为:吸收随乙酸乙酯蒸出的少量酸性物质和乙醇;
(5)乙酸乙酯,其密度比水小,所以在碳酸钠溶液层上方有无色油状液体出现,故答案为:b中的液体分层,上层是透明的油状液体。
点评:本题考查了乙酸乙酯的制备,解答时须注意酯化反应的原理和饱和碳酸钠溶液的作用,题目难度不大。
本题难度:一般
2、选择题 为制备干燥、纯净的CO2,将大理石和盐酸反应生成的气体先后通过装有下列物质的两个吸收装置,两个装置中应依次装入 [???? ]
A.水;无水CaCl2固体
B.饱和NaHCO3溶液;浓H2SO4
C.浓H2SO4;饱和Na2CO3溶液
D.饱和Na2CO3溶液;稀H2SO4
参考答案:AB
本题解析:
本题难度:简单
3、实验题 (12分)为除去粗盐中的Ca2+、Mg2+、SO 以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
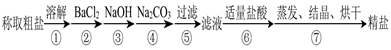
(1)在第①步和第⑤步中都需要用到玻璃棒,其作用分别是_____________、______________。
(2)判断BaCl2已过量的方法是_____________________________________________________。
(3)第④步中,相关的离子方程式是________________________________________________。
(4)若先用盐酸再过滤,将对实验结果产生影响,其原因是____________________________。
参考答案:(1)搅拌,加速固体溶解 ;引流 。
(2)取上层清液
本题解析:
试题分析:(1)在第①步,玻璃棒作用是搅拌,加速固体溶解;第⑤步在过滤操作玻璃棒的作用是引流。(2)取上层清液,继续加BaCl2,无沉淀产生,说明BaCl2已过量。另外判断BaCl2已过量也可以看Ba2+是不是过量,即是取上层清液,加入少量稀硫酸,有沉淀产生。(3)在第②步中除去SO42-,在第③步中除去Mg2+,所以第④步中除去Ca2+及过量的Ba2+,所以Ca2++CO32-=CaCO3↓,Ba2++CO32-=BaCO3↓. (4)若过滤前加盐酸, CaCO3和BaCO3会与盐酸反应,又形成Ca2+和Ba2+进入溶液。
点评:考查了化学实验的一些基本操作,以及除杂加入试剂的顺序,和离子方程式的书写,都是高考化工流程题的常见考点。
本题难度:一般
4、实验题 (10分) 硫酸亚铁(FeSO4·7H2O)是一种重要的食品和饲料添加剂。实验室通过如下实验由废铁屑制备FeSO4·7H2O晶体:①将5% Na2CO3溶液加入到盛有一定量废铁屑的烧杯中,加热数分钟,用倾析法除去Na2CO3溶液,然后将废铁屑用水洗涤2 ~ 3遍;②向洗涤过的废铁屑中加入过量的稀硫酸,控制温度在50 ~ 80℃之间至铁屑耗尽;③趁热过滤,将滤液转入到密闭容器中,静置、冷却结晶;④待结晶完毕后,滤出晶体,用少量冰水洗涤2 ~ 3次,再用滤纸将晶体吸干;⑤将制得的FeSO4·7H2O晶体放在一个小广口瓶中,密闭保存。请回答下列问题:
(1)写出Fe2+的核外电子排布式??????????????????????
(2)用轨道表示式表示Fe3+的3d电子的排布情况??????????????????
(3)硫酸亚铁制备中实验步骤①的目的是???????????????? ??????。
(4)实验步骤②明显不合理,理由是???????????????????????????????。
(5)实验步骤④中用少量冰水洗涤晶体,其目的是?????????????????????。
参考答案:(1)[Ar]3d6??????(2)? 本题解析:(1)根据构造原理可写出Fe2+的核外电子排布式为[Ar]3d6。
本题解析:(1)根据构造原理可写出Fe2+的核外电子排布式为[Ar]3d6。
(2)洪特规则电子总是优先占据1个轨道,并且自旋方向相同,所以Fe3+的3d电子的排布情况是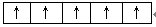 。
。
(3)碳酸钠溶液显碱性,可以除去铁屑上的油污。
(4)亚铁离子易被氧化生成铁离子,所以必须让铁过量,防止Fe2+被氧化成Fe3+。
(5)晶体表面会吸附溶液中的稀硫酸,所以用水洗涤晶体中混有的稀硫酸,减少洗涤过程中晶体的损耗。
本题难度:一般
5、选择题 拟用右图所示装置制取四种干燥、纯净的气体(图中加热装置和气体的收集装置均已略去;必要时可以加热;a、b、c、d表示相应仪器中加入的试剂)。其中不能达到目的的是:
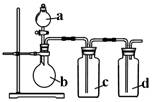
选项
| 制取气体
| a
| b
| c
| d
|
A
| NO
| 稀硝酸
| 铜片
| H2O
| 浓硫酸
|
B
| O2
| 双氧水
| MnO2
| H2O
| 浓硫酸
|
C
| NH3
| 浓氨水
| 碱石灰
| 浓硫酸
| H2O
|
D
| SO2
| 浓盐酸
| Na2SO3粉末
| NaHSO3溶液
| 浓硫酸
参考答案:C
本题解析:略
本题难度:简单
|