微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 中学化学涉及多种常数,下列说法正确的是
A.两种物质反应,不管怎样书写化学方程式,平衡常数不变
B.某温度下,2L密闭容器中加入4 mol a和2 mol b发生反应:3A(g) +2B(g)  4C(1)+2D( g)。平衡时测得n(C)="1.6mol" ,反应的化学平衡常数表达式为
4C(1)+2D( g)。平衡时测得n(C)="1.6mol" ,反应的化学平衡常数表达式为
C.温度一定时,当溶液中。( Ag+)·c( Cl-)等于Ksp值时,此溶液为AgCI的饱和溶液
D.难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,? c(B-)="y" mo·L-1,则Ksp值为4xy2
参考答案:C
本题解析:
试题分析:A.衡常数与书写化学方程式有关的,错误;B.液体的浓度是不变的,故在平衡常数表达式中不写入,错误;C.温度一定时,当溶液中。( Ag+)·c( Cl-)等于Ksp值时,此溶液为AgCI的饱和溶液,正确;D.难溶电解质AB2饱和溶液中,c(A2+)=xmol·L-1,? c(B-)="y" mo·L-1,Ksp值应该为2x2y,错误;
本题难度:一般
2、选择题 在一定条件下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g) C(g)+D(g)已达平衡的是(???)
C(g)+D(g)已达平衡的是(???)
A.混合气体的压强
B.混合气体的密度
C.B的物质的量浓度
D.混合气体的平均相对分子质量
参考答案:A
本题解析:
试题分析:由于该反应是个反应前后气体体积相等的可逆反应。所以无论反应是否达到平衡,混合气体的压强都不会发生变化。因此不能作为判断平衡的依据。正确。B.由于反应有固体物质参加。若反应未达到平衡,反应正向进行混合气体的质量增大,气体的密度增大;若反应逆向进行,则气体物质的质量减小,气体的密度减小。只有反应达到平衡时,气体的质量和密度才保持不变。因此可以作为反应达到平衡的标志。错误。C.若反应未达到平衡,B的物质的量就会发生变化,B的浓度也会发生改变。因此可以作为判断平衡的标志。错误。? D.由于反应前后气体的物质的量不变,若反应达到平衡,混合气体的质量就不变,气体的平均相对分子质量也不变;若反应未达到平衡,气体的质量就要发生变化 ,气体的摩尔质量或混合气体的平均相对分子质量就要发生变化。因此可以作为判断反应达到平衡的标志。错误。
本题难度:一般
3、选择题 一定温度下,反应N2(g)+3H2(g) 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g) 2N2(g)+6H2(g)反应热和化学平衡常数为(???? )
2N2(g)+6H2(g)反应热和化学平衡常数为(???? )
A.2△H和2K
B.-2△H和 K2
C.-2△H和 K-2
D.2△H和-2K
参考答案:C
本题解析:反应热和化学计量数成之比,即反应热是-2△H;平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据方程式可知,选项C正确,答案选C。
本题难度:简单
4、填空题 (5分)可逆反应3A(g) 3B(?)+C(?)? △H>0达到化学平衡后,
3B(?)+C(?)? △H>0达到化学平衡后,
(1)升高温度,用“变大”、“变小”、“不变”或“无法确定”填空。
a.若B、C都是气体,气体的平均相对分子质量①?;
b.若B、C都不是气体,气体的平均相对分子质量?② ;
c.若B是气体,C不是气体,气体的平均相对分子质量③ ;
(2)如果平衡后保持温度不变,将容器体积增加一倍,新平衡时A的浓度是原来的60%,则B是④?态,C是⑤?态。
参考答案:①变小?②不变?③变小?④固态或液态??⑤气态(各1分共5分
本题解析:
试题分析:可逆反应3A(g) 3B(?)+C(?)? △H>0?,
3B(?)+C(?)? △H>0?,
气体的平均相对分子质量=m气体总/n气体总
a.若B、C都是气体,反应前后,气体质量守,而且该反应是气体体积增大的反应,升高温度 ,平衡向正向移动,即向体积增大的方向移动, 所以气体的平均相对分子质量变小。
b.若B、C都不是气体,只有反应物是气体所以反应前后,气体的平均相对分子质量不变。
若B是气体,C不是气体,反应前后,气体质量减少,而气体体积反应前后不变,所以气体的平均相对分子质量变小;如果平衡后保持温度不变,将容器体积增加一倍,如果平衡不再移动,新平衡时A的浓度是原来的50%,但是新平衡时A的浓度是原来的60%,说明平衡向逆反应方向移动,即,减小压强,平衡向体积增大的方向移动,该方向是逆向,所以反应前的气体体积数大于反应后的气体体积数,则B是固态或液态?? C是气态。
点评:解答此类试题要求学生对反应前后体积变化的反应,气体的平均相对分子质量是不是变化,要看气体的平均相对分子质量=m气体总/n气体总中气体总质量和气体总的物质的量是不是变化来分析。
本题难度:一般
5、选择题 对于可逆反应:2A(g)+B(g) 2C(g);△H<0,下列图象正确的是(?? )
2C(g);△H<0,下列图象正确的是(?? )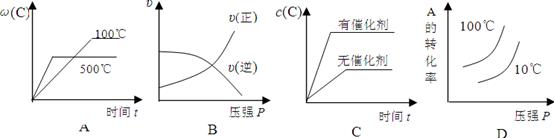
参考答案:A
本题解析:
试题分析:根据反应的方程式可知,该反应是体积减小的、放热的可逆反应。所以升高温度,平衡向逆反应方向移动,A正确,D不正确;增大压强正逆反应速率都增大,平衡向正反应方向移动,B不正确;催化剂不能改变平衡状态,C不正确,答案选A。
点评:在分析有关图像时应该注意:一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。?二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。
本题难度:一般