微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (4分)在温度T下,c(OH-)=0.1 mol·L-1的Ba(OH)2的PH值为11。
(1)该温度下,100ml水中含有OH-约有_ 个。
(2)该温度下,在PH=8的Ba(OH)2溶液中加入PH=5的盐酸,欲使混合溶液pH=7,则Ba(OH)2溶液与所加盐酸的体积比为__ __
参考答案:(4分)(1)_ 10-7 NA
本题解析:因为题目告诉PH=11,所以H+浓度应为10-11mol/L。根据溶液离子积的算法:KW=C(H+)×C(OH-)=10-11×10-1=10-12。
(1)该温度下,水是中性,OH-浓度等于H+浓度,根据上面算出的离子积可推知,C(OH-)=10-6,物质的量应为10-7,再根据N/NA=n,可得100ml水中含有OH-约有10-7 NA。
(2)溶液混合后PH=7,根据离子积常数,可判断该溶液应该是碱性溶液。设Ba(OH)2溶液体积为V1,盐酸溶液体积V2,再依据混合溶液PH值计算方法列出计算式:[C(OH-)×V1—C(H+)×V2]/(V1+V2)=10-5。由该计算式可得V1/V2=2/9
本题难度:一般
2、选择题 常温下,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,已知相同条件下氨水的电离程度大于NH4+的水解程度,则下列有关推论不正确的是
A.若混合后溶液pH=7,则c(NH4+)=c(Cl-)
B.若b=2a,则c(Cl-)>c(NH4+)>c(H+)>c(OH-)
C.若a=2b,则c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D.若混合后溶液满足c(H+)=c(OH-)+c(NH3·H2O),则可推出a=b
参考答案:B
本题解析:
试题分析:A、溶液中存在c(Cl-)+c(OH-)=c(H+)+c(NH4+),因c(OH-)=c(H+),则有c(NH4+)=c(Cl-),正确;B、若b=2a,盐酸过量,应有c(H+)>c(NH4+),即c(Cl-)>c(H+)>c(NH4+)>c(OH-),错误;C、若a=2b,反应后生成的NH4Cl和剩余的NH3?H2O的物质的量相等,已知相同条件下MOH的电离程度大于NH4+的水解程度,则c(NH4+)>c(Cl-)>c(NH3?H2O)>c(OH-)>c(H+),正确;D、如果a=b,完全反应生成NH4Cl,根据质子守恒可知c(H+)=C(OH-)+c(NH3?H2O),正确。
考点:本题考查离子浓度比较。
本题难度:一般
3、选择题 下列电离方程式错误的是
[???? ]
A、CaCl2 = Ca2+ + 2Cl-
B、NaHSO4 = Na+ + H+ + SO42-
C、NaHCO3 = Na+ + HCO3-
D、KClO3 = K+ + Cl- + 3O2-
参考答案:D
本题解析:
本题难度:简单
4、实验题 (14分)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净并检查不漏水,且用待测溶液润洗后,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放入25.00 mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净并检查不漏水后,立即向其中注入0.1000 mol/L标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至指示剂刚好变色,且在30 s内颜色不再变化,测得所耗盐酸的体积为V1 mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5 mL的蒸馏水,测得所耗盐酸的体积为V2 mL。
试回答下列问题:
(1)锥形瓶中的溶液从_____色变为_____色时,停止滴定。
(2)滴定时边滴边摇动锥形瓶,眼睛应观察_____。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(3)该小组在步骤①中的错误是__________。由此造成的测定结果_____(填“偏高”、“偏低”或“无影响”)
(4)步骤②缺少的操作是__________。
(5)如图,是某次滴定时的滴定管中的液面,其读数为_____ mL。
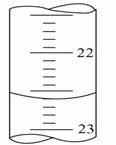
参考答案:⑴红(2分) 浅红(或粉红)(2分)⑵B (2分)⑶用待测液
本题解析:
试题分析:(1)溶液从碱性逐渐变为中性过程中溶液颜色变化化为:从红色变为浅红色。(2)滴定过程中眼睛要注视锥形瓶中的溶液颜色变化。(3)操作过程中错误的是:用待测液润洗锥形瓶,如果用待测液润洗锥形瓶,会造成待测液增多,盐酸的用量增大,测出来的浓度偏高。(4)滴定前要用用标准液润洗滴定管,否则会造成标准液浓度变小,测出来的待测液浓度偏高。(5)从图看出滴定管每一小格是0.1 mL,液面刚好与6格处相切,读数要保留小数点后2为,故读数为22.60 mL
考点:酸碱中和滴定。
本题难度:一般
5、选择题 常温时,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
A.(10-8+10-10)mol/L
B.2×10-10 mol/L
C.1/2(10-8+10-10)mol/L
D.(10-4+10-6)mol/L
参考答案:B
本题解析:略
本题难度:简单