微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为(?? )
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,则SO2在平衡混合物中的体积分数为(?? )
A.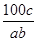 ×100%
×100%
B. ×100%
×100%
C. ×100%
×100%
D.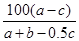 %
%
参考答案:D
本题解析:
试题分析:在反应2SO2+O2 2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,所以平衡时该混合气体的气体的总的物质的量为a+b-0.5c,而平衡时二氧化硫的气体的物质的量为a-c,所以则SO2在平衡混合物中的体积分数为
2SO3中,有a mol SO2和b mol O2参加反应,达到化学平衡状态时有c mol SO3生成,所以平衡时该混合气体的气体的总的物质的量为a+b-0.5c,而平衡时二氧化硫的气体的物质的量为a-c,所以则SO2在平衡混合物中的体积分数为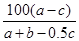 ?%,所以本题的答案选择D。
?%,所以本题的答案选择D。
点评:本题考查了体积分数的计算,该考点是高考考查的热点,本题比较容易。
本题难度:一般
2、选择题 在一个6 L的密闭容器中放入3 L X气体和2 L Y气体,在一定条件下发生下列反应:4X(g)+3Y(g)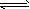
2Q(g)+nR(g)当反应达平衡后,容器内温度不变,混合气体的压强比原来增大5%,X的浓度减小,则该反应式中n的值为 [???? ]
A.3
B.4
C.5
D.6
参考答案:D
本题解析:
本题难度:一般
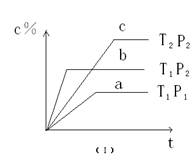
3、选择题 在某密闭容器中,可逆反应:A(g)+B(g) xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
xC(g),符合下列图像(Ⅰ)所示关系。由此推断对图像(Ⅱ)的正确说法是
 ???????????
???????????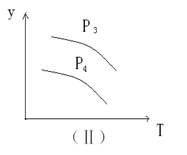
A.P3﹥P4 , y轴表示A的百分含量
B.P3﹤P4 , y轴表示B的百分含量
C.P3﹤P4 , y轴表示混合气体的密度
D.P3﹥P4 , y轴表示混合气体的 平均相对分子质量
平均相对分子质量
参考答案:D
本题解析:略
本题难度:一般
4、选择题 在容积一定的密闭容器中,反应2A B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是???????(??????? )
B(g)+C(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述正确的是???????(??????? )
A.正反应是放热反应,且A是气态
B.正反应是吸热反应,且A不是气态
C.其他条件不变,加入少量A,该平衡向正反应方向移动
D.改变压强对该平衡的移动无影响
参考答案:B
本题解析:
试题分析:此题关键在于升高温度容器内气体的密度增大,由此可以判断出反应前后气体分子数发生了变化,那么可以判断出A物质不是气态,且反应向右进行,即为吸热反应。A、错误;B、正确;C、由于A不是气态加入少量A物质不能改变反应物的浓度。D、反应前后气体分子数发生变化,改变压强平衡移动。
本题难度:一般
5、计算题 (9分)某温度时,在2? L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如下表所示。
(1)根据下表中数据,在下图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线: