微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (14分)铝土矿(主要成分为Al2O3、SiO2、Fe2O3)是提取氧化铝的原料。提取氧化铝的工艺流程如下:
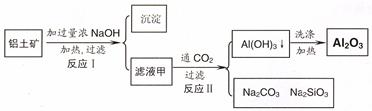 ??
??
(1)滤液甲的主要成分是(写化学式)????????????
(2)写出反应 II 的离子方程式:??????????????????????????????????????????????????
(3)结合反应II,判断下列微粒结合质子 ( H+) 的能力,由强到弱的顺序是????????(填字母序号)
A.AlO2―?????? B.OH―??????? C.SiO32―
(4)取滤液甲少许,加入过量盐酸,过滤;再用惰性电极电解其滤液,两极均有气体产生,且全部逸出,在阴极区还有沉淀生成,最后沉淀消失。沉淀消失的原因可用离子方程式表示为:???????????????????????????????????????????????????????????????????
(5)取 (4) 电解以后的溶液 10.0 mL,经分析,该溶液中只含有两种等物质的量浓度的碱性溶质,向其中逐滴加入0.100 mol? L-1盐酸溶液,当加入50.0mL 盐酸溶液时,生成的沉淀恰好溶解。
①加入50.0mL 盐酸溶液发生的离子反应的先后顺序依次为:????????????????????
②请画出生成沉淀的物质的量与加入盐酸体积的关系图。
参考答案:⑴ NaOH、NaAlO2、Na2SiO3 ?
⑵ C
本题解析:
试题分析:(1)铝土矿中加入过量的NaOH溶液,其中的Al2O3、SiO2发生反应得到NaAlO2、Na2SiO3和过量的NaOH溶液,所以滤液甲的主要成分是NaAlO2、Na2SiO3、NaOH;不溶性的固体是Fe2O3。(2)向含有NaAlO2、Na2SiO3、NaOH的溶液中通入过量CO2,发生反应CO2+2OH-=CO32-+2H2O ;CO2+2H2O +2AlO2-==2Al(OH)3↓+HCO3-,得到Al(OH)3沉淀。(3)H2O是中性物质;Al(OH)3是两性物质,H2SiO3
本题难度:一般
2、实验题 右图中所示装置的实验如下:先关闭K,使A中反应进行,加热玻璃管C,可观察到C管中发出耀眼白光,产生白烟,管壁上附着有淡黄色物质。实验完成后将C管中固体全部加入盐酸中,有臭鸡蛋气味的气体生成。
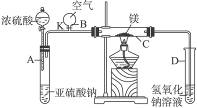
(1)C中的Mg应放在不锈钢垫片上而不能直接接触管壁,这是因为___________________
______________________________________________________________________________。
(2)停止实验时,先打开K,再停止滴加浓硫酸并熄灭酒精灯,橡胶气胆B在实验中的作用是______________________________________________________________________________。
(3)C中全部反应产物有______________、______________、______________。(填化学式)
参考答案:(1)4Mg+SiO2 本题解析:(1)一般两种物质不能直接接触,应考虑两者之间可能发生化学反应。Mg是强还原剂,可能与SiO2反应,夺取SiO2中的氧元素。
本题解析:(1)一般两种物质不能直接接触,应考虑两者之间可能发生化学反应。Mg是强还原剂,可能与SiO2反应,夺取SiO2中的氧元素。
(2)NaOH溶液是用来吸收SO2的,若根据一般的操作顺序:先撤导管,再熄灭酒精灯,这样虽不会倒流,但会污染空气。按题中操作顺序,虽不会造成大气污染,但若不维持C管里的压强,肯定会倒流,所以气胆B的作用是被充气体维持C中的压强。
(3)题中所列现象,由已熟悉CO2与Mg反应的产物可判断C中全部反应产物。冒白烟即产生了MgO,淡黄色固体肯定为S,与酸反应产生了H2S,生成
本题难度:简单
3、计算题 (10分)铝镁合金现已成为轮船制造、化工生产等行业的重要原料。现有一块铝镁合金,欲测定其中镁的质量分数,几位同学分别称取c克样品,并设计了不同的实验方案:
甲:铝镁合金 测得生成气体的体积Vml(已折算成标准状况);
测得生成气体的体积Vml(已折算成标准状况);
乙:铝镁合金 测得剩余固体的质量a克;?
测得剩余固体的质量a克;?
丙:铝镁合金 溶液
溶液 测得沉淀的质量b克。
测得沉淀的质量b克。
(1)写出甲方案的有关反应的离子方程式:? 。
该方案能否测定出镁的质量分数? (填“能”或“不能”)。
(2)乙方案所加入的试剂是 ,测定出镁的质量分数为??????????。
(3)丙方案测得沉淀的质量为b克,加过量的NaOH溶液充分反应后, ?? (填一种分离方法)、洗涤、烘干沉淀。若c=40,b=2.9,则测得镁的质量分数为 ?? 。如果未洗涤沉淀,测得镁的质量分数将 (填“偏大”、“偏小”或“无影响”)。
参考答案:(共10分)
(1)2Al+6H+ ="=" 2Al3
本题解析:(1)镁和铝都是活泼的金属,能和盐酸反应生成氢气,方程式为2Al+6H+ ="=" 2Al3++3H2↑、Mg + 2H+ ="=" Mg2+?+ H2↑。根据合金的质量和氢气的体积可以计算出镁的质量分数。
(2)铝能溶解在氢氧化钠溶液中,但镁不能,所以乙方案中但试剂是氢氧化钠溶液。剩余固体是镁,质量为ag,所以镁但质量分数为100a/c%。
(3)丙方案中,加入过量但氢氧化钠溶液后生成氢氧化镁沉淀和偏氯酸钠,过滤即得到氢氧化镁沉淀。氢氧化镁是2.9g,则含有镁的质量是 本题难度:一般
本题难度:一般
4、选择题 将5.1gMgAl合金溶解在过量的500mL2mol/L的盐酸中,然后加入4mol/LNaOH溶液。若要使生成的沉淀最多,则应加入的这种NaOH溶液的体积是
A.200mL
B.250 mL
C.425mL
D.560mL
参考答案:B
本题解析:在整个过程中相当于盐酸和氢氧化钠反应,故有0.5L×2mol/L=V×4mol/L,V=250ml。
本题难度:一般
5、选择题 熔化氢氧化钾固体应选用的仪器是(???)
A.瓷坩埚
B.石英坩埚
C.氧化铝坩埚
D.铁坩埚
参考答案:D
本题解析:瓷坩埚和石英坩埚的主要成分都含有酸性氧化物SiO2,SiO2能与强碱反应,氧化铝坩埚由氧化铝构成,能与强碱反应,只有铁不会与碱反应。
本题难度:简单