微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (14分)某实验小组用0.50 mol·L- 1 NaOH溶液和0.50mol·L- 1 的硫酸溶液进行中和热的测定。
 Ⅰ.配制0.50mol·L- 1 硫酸溶液
Ⅰ.配制0.50mol·L- 1 硫酸溶液
(1)若配制250 mL硫酸溶液,则须用量筒量取密度为1.84 g·cm- 3、质量分数为98%的浓硫酸 mL。
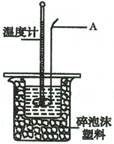
Ⅱ.测定稀硫酸和稀氢氧化钠溶液中和热的实验装置如右图所示:
(2)仪器A的名称为 ;
(3)装置中碎泡沫塑料的作用是 ;
(4)写出该反应中和热的热化学方程式:(中和热为57.3 kJ·mol- 1) ;
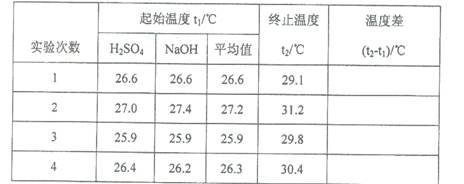
(5)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①下表中的温度差平均值为 ℃;
②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H= (取小数点后一位)。
③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是(填字母) 。
A.实验装置保温、隔热效果差
B.量取NaOH溶液的体积时仰视读数
C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中
D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
参考答案:Ⅰ.(1)6.8;Ⅱ.(2)环形玻璃搅拌棒;(3)保温、隔热
本题解析:
试题分析:Ⅰ.(1)在稀释前后溶质的物质的量不变。(0.50mol/L×0.25L)×98g/mol="1.84" g·cm- 3×V×98%,解得V=6.8ml;(2)仪器A的名称为环形玻璃搅拌棒;(3)装置中碎泡沫塑料的作用是保温、隔热,减少热量的损失,是测定的温度更准确;(4)由于中和热是可溶性强酸与可溶性强碱的稀溶液发生反应产生可溶性盐和1mol的水时所放出的热量,因此该反应中和热的热化学方程式:1/2H2SO4(aq)+NaOH(aq) =1/2Na2SO4(aq)+ H2O(l)ΔH=-57.3KJ/mol;(5)由于酸、碱物质的量浓度相同,而酸是二元酸,素若取50 mL NaOH溶液和30 mL硫酸溶液进行实验,则酸过量,反应放出的热量按照碱进行计算。 ①通过对表中各组数据进行观察会发现:第一组数据偏差太大,应该舍去,因此表中的温度差平均值为[(31.2-27.2)+(29.8-25.9)+(30.4-26.4)]÷3="4.0℃;" ②近似认为0.50mol·L- 1 NaOH溶液和0.50mol·L- 1 硫酸溶液的密度都是1g·cm- 3 ,中和后生成溶液的比热容c=" 4.18" J·(g·℃)- 1 。则中和热△H=-cmt÷n=(4.18×10-3×80×4.0)KJ÷0.025mol="-53." 5KJ/mol. ③上述实验数值结果与57.3 kJ·mol- 1 有偏差,产生此实验偏差的原因可能是A.实验装置保温、隔热效果差,热量散失,使结果偏低,正确; B.量取NaOH溶液的体积时仰视读数,碱的物质的量偏大,则热量偏多,使结果偏高,错误; C.一次性把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失少,误差小,错误; D.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,使在测定前已经由部分发生反应,是热量测定值偏少,正确。故选项是AD。
考点:考查物质的量浓度的配制、中和热的热化学方程式的书写、中和热的计算、测定及误差分析的知识。
本题难度:一般
2、选择题 下列说法或表示正确的是 ( )
A.将等质量硫蒸气和硫粉分别完全燃烧,前者放出热量多
B.由“C(石墨) ·mol-1可知金刚石比石墨稳定
·mol-1可知金刚石比石墨稳定
C.稀的强酸和稀的强碱溶液反应的热化学方程式均为:
H++OH-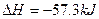 ·mol-1
·mol-1
D.在25℃、101 kPa时,1克氢气完全燃烧生成H2O放出热量142.9kJ。则:
2H2O(1) 2H2(g)+ O2(g);
O2(g); ·
· mol-1
mol-1
参考答案:A
本题解析:略
本题难度:简单
3、选择题 下列叙述正确的是 ①化学反应都遵循质量守恒定律 ②化学反应都遵循能量守恒定
下列叙述正确的是
①化学反应都遵循质量守恒定律
②化学反应都遵循能量守恒定律
③化学反应都有新物质生成
④化学反应都伴随着能量变化
⑤化学反应都有化学键的破坏和生成
A.①
B.①②⑤
C.①②③⑤
D.①②③④⑤
参考答案:D
本题解析:化学反应的特征③④⑤,同时化学反应遵守①质量守恒定律,②能量守恒定律。
本题难度:一般
4、选择题 在下列各说法中,正确的是
A.ΔH<0表示放热反应,ΔH>0表示吸热反应
B.如果反应物所具有的总能量小于生成物所具有的总能量,则发生的反应是放热反应
C.在稀溶液中1mol酸和1mol碱完全反应所放出的热量,叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
参考答案:A
本题解析:
试题分析:A.按照规定,放热反应的焓变为负值,吸热反应的焓变为正值,正确;B.如果反应物所具有的总能量小于生成物所具有的总能量,则该反应是吸热反应,错误;C.在稀溶液中,强酸和强碱完全反应生成1mol水时所放出的热量,叫做中和热,错误;D.1 mol H2与0.5 mol O2反应生成液态水时放出的热就是H2的燃烧热,错误;选A。
考点:考查化学反应的热量变化,中和热和燃烧热的概念等知识。
本题难度:一般
5、填空题 (5分)用相关的化学用语表示下列物质:
⑴ 写出电子式Al3+?????????????Cl ???????????????
⑵ 写出下列物质的结构式:N2 ???????????????????CO2???????????????????
⑶ 用电子式表示NaOH_______________________
参考答案:略
本题解析:
试题分析:(1)电子式是在元素符号周围用×或点表示元素原子的最外层电子,故阳离子Al3+本身就是它的电子式,氯原子最外层有7个电子,在Cl元素符号周围写上7个电子即为电子式;(2)氮气分子中存在氮氮三键,故结构式为:N≡N;二氧化碳中碳和氧之间是碳氧双键,故结构式为:O=C=0;(3)离子化合物的电子式表示出阳离子和阴离子,钠离子的电子式就是钠离子本身,写上氢氧根离子的电子式即得氢氧化钠的电子式。
本题难度:一般