微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 根据下表提供的数据,下列判断正确的是

A.等物质的量的Na2CO3和CH3COOH两种溶液混合,一定有:
B.常温下,已知酸H2A存在如下平衡: ;
;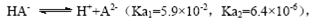 ,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
,则NaHA溶液中水的电离程度一定大于纯水中水的电离程度
C.相同浓度的CH3COONa和NaClO混合溶液中各离子浓度大小关系是:c(Na+)> c(ClO-)> c(CH3COO-)> c(OH-)>c(H+)
D.常温下,在0.1mol/LCH3COOH溶液中滴加0.1mol/LNaOH的溶液发生反应,当c(CH3COOH):c(CH3COO-)=5:9时,此时溶液pH=5
2、选择题 高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数
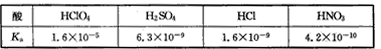
从以上表格中判断下列说法正确的是? [???? ]
A.在冰醋酸和水中这四种酸都没有完全电离
B.在冰醋酸中高氯酸是这四种酸中最弱的酸
C.在冰醋酸中硫酸的电离方程式为H2SO4==2H++SO42-
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
3、选择题 H2O2是一种二元弱酸,对于0.1 mol·L-1的过氧化氢溶液,下列叙述不正确的是(??)
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2-
H++HO2-,HO2- H++O42-
H++O42-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
4、选择题 将pH=8的NAOH溶液与pH=10的NAOH溶液等体积混合后,形成的溶液中氢离子浓度最接近于(???)
A. (10-8-10-10) mol·L-1
(10-8-10-10) mol·L-1
B.(10-8+10-10) mol·L-1
C.(1×10-14-5×10-5) mol·L-1
D.2×10-10 mol·L-1
5、填空题 实验室中有6瓶失去标签的白色固体:纯碱、氢氧化镁、氯化钡、硫酸铝、硫酸氢钠、氯化钾。除蒸馏水、试管和胶头滴管外,无其他任何试剂和仪器。某学生通过以下实验步骤即可鉴别它们。请填写下列空白:
(1)各取适量固体于6支试管中,分别加入适量蒸馏水,有一支试管中的现象和其他5支明显不同,此支试 管中的现象是___________,据此现象鉴别出的一种物质是__________。
(2)分别将所剩5种溶液依次编号为A、B、C、D、E,然后进行两两混合。观察到C没有出现任何现象;D分别和A、B、E混合时均产生了白色沉淀;B和E混合时既有白色沉淀产生,又有无色气体放出。据此可 推断出:
①A、C、D三种物质的化学式依次是______________;
②B、E两者中有一种可与A反应,它与足量A反应的离子方程式为:_______________;
③在两两混合时,能最终确定B、E成分的实验现象及结论是:___________________;
(3)上述物质溶于水抑制水的电离,且溶液显酸性的物质的化学式为_____________,其溶液显酸性的原因是___________________。