微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 已知H2(g)+I2(g) ?2HI(g);△H<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI?0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 [???? ]
?2HI(g);△H<0有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI?0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是 [???? ]
A.?甲、乙提高相同温度????
B.?甲中加入0.1mol?He,乙不改变
C.?甲降低温度,乙不变????
D.?甲增加0.1mol?H2,乙增加0.1mol?I2
参考答案:C
本题解析:
本题难度:一般
2、选择题 反应SO2(g)+NO2(g) NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 [???? ]
NO(g)+SO3(g)在一定条件下建立平衡,再加入一定量的O2,下列说法正确的是 [???? ]
A.平衡左移,容器内压强不一定增大
B.平衡右移,达到平衡时容器压强不一定增大
C.平衡不一定发生移动,容器内压强一定增大
D.平衡右移,SO2的转化率提高
参考答案:BD
本题解析:
本题难度:一般
3、选择题 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是[???? ]
A.
B.
C.
D.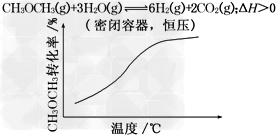
参考答案:D
本题解析:
本题难度:一般
4、选择题 下列事实不能用勒夏特列原理解释的是( )
A.氨水应密闭保存,放置于低温处
B.在硫酸亚铁溶液中,加入铁粉以防止氧化变质
C.生产硝酸的过程中使用过量空气以提高氨气的利用率
D.实验室常用排饱和食盐水的方法收集氯气
参考答案:A、氨水中存在化学平衡:NH3+H2O?NH3?H2O,平衡
本题解析:
本题难度:简单
5、填空题 (12分)(1)已知在一定温度下:C(s)+CO2(g) 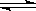 2CO(g)平衡常数K;
2CO(g)平衡常数K;
C(s) + H2O(g) 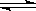 CO(g)+H2(g) 平衡常数K1;
CO(g)+H2(g) 平衡常数K1;
CO(g)+H2O(g)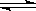 H2(g)+CO2(g) 平衡常数K2 ,
H2(g)+CO2(g) 平衡常数K2 ,
则K、K1、K2之间的关系是: 。
(2)MnO2的生产方法之一是以石墨为电极,电解酸化的MnSO4溶液。阳极的电极反应式是 。
。
(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为 ,滴定终点时的颜色变化为 。
(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,会造成测定结果 。(填“偏大”、“偏小”或“无影响”)
(5)如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是 。
把NaHCO3和FeCl3溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程为 。
(6)怎样除去锅炉中难溶的硫酸钙沉淀?
(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液与pH=9的NaOH溶液混合并保持恒温,当混合溶液的pH=7时,H2SO4溶液与NaOH溶液的体积比为 。
参考答案:(1)K=K1/K2(1分)
(2)Mn2+-2e-+
本题解析:
试题分析:(1)反应C(s)+CO2(g) 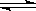 2CO(g)的平衡常数表达式K=[CO]2/[CO2];C(s)+ H2O(g)
2CO(g)的平衡常数表达式K=[CO]2/[CO2];C(s)+ H2O(g) 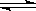 CO(g)+H2(g)的平衡常数表达式K1="[CO]" [H2]/[ H2O];CO(g)+H2O(g)
CO(g)+H2(g)的平衡常数表达式K1="[CO]" [H2]/[ H2O];CO(g)+H2O(g)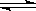 H2(g)+CO2(g) 平衡常数表达式K2 =[CO2] [H2]/[ H2O] [CO],则K、K1、K2之间的关系是:K=K1/K2。(2)以石墨为电极,电解酸化的MnSO4溶液制备MnO2。阳极发生氧化反应,电极反应式是Mn2+-2e-+2H2O=MnO2+4H+
H2(g)+CO2(g) 平衡常数表达式K2 =[CO2] [H2]/[ H2O] [CO],则K、K1、K2之间的关系是:K=K1/K2。(2)以石墨为电极,电解酸化的MnSO4溶液制备MnO2。阳极发生氧化反应,电极反应式是Mn2+-2e-+2H2O=MnO2+4H+ ;(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为淀粉,滴定终点时的颜色变化为无色变为蓝色;(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,代入公式计算的标准氢氧化钠溶液的体积偏大,会造成测定结果偏大;(5)为防止氯化铁水解,从氯化铁溶液得到纯氯化铁固体,常采用的方法是将三氯化铁溶液在HCl气流(或气氛)中加热蒸干;把NaHCO3和FeCl3溶液混合,将产生红褐色氢氧化铁沉淀和无色气体二氧化碳,该反应的离子方程为Fe3+ + 3HCO3-= Fe(OH)3↓+3CO2↑;(6)利用沉淀转化的原理,除去锅炉中难溶的硫酸钙沉淀的方法是加入饱和碳酸钠溶液浸泡一段时间后(硫酸钙转化为碳酸钙),将溶液倒出,再加入适量的醋酸洗涤;(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液中c(H+)=10—4mol/L,与pH=9的NaOH溶液中c(OH-)=10—3mol/L,将二者混合并保持恒温,混合溶液的pH=7时溶液呈碱性,c(OH-)=10—5mol/L,则有[10—3mol/L ·V (NaOH)—10—4mol/L ·V (H2SO4)]÷[V (NaOH)+V (H2SO4)]= 10—5mol/L,则二者的体积比为9:1。
;(3)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢铁中的硫转化为H2SO3,装入锥形瓶中,用一定浓度的标准I2溶液进行滴定,所用指示剂为淀粉,滴定终点时的颜色变化为无色变为蓝色;(4)用标准NaOH溶液滴定盐酸时,滴定前俯视读数,滴定后仰视读数,代入公式计算的标准氢氧化钠溶液的体积偏大,会造成测定结果偏大;(5)为防止氯化铁水解,从氯化铁溶液得到纯氯化铁固体,常采用的方法是将三氯化铁溶液在HCl气流(或气氛)中加热蒸干;把NaHCO3和FeCl3溶液混合,将产生红褐色氢氧化铁沉淀和无色气体二氧化碳,该反应的离子方程为Fe3+ + 3HCO3-= Fe(OH)3↓+3CO2↑;(6)利用沉淀转化的原理,除去锅炉中难溶的硫酸钙沉淀的方法是加入饱和碳酸钠溶液浸泡一段时间后(硫酸钙转化为碳酸钙),将溶液倒出,再加入适量的醋酸洗涤;(7)某温度下,水的离子积常数Kw = 1.0×10-12mol2·L-2。该温度下,将pH=4的H2SO4溶液中c(H+)=10—4mol/L,与pH=9的NaOH溶液中c(OH-)=10—3mol/L,将二者混合并保持恒温,混合溶液的pH=7时溶液呈碱性,c(OH-)=10—5mol/L,则有[10—3mol/L ·V (NaOH)—10—4mol/L ·V (H2SO4)]÷[V (NaOH)+V (H2SO4)]= 10—5mol/L,则二者的体积比为9:1。
考点:考查化学平衡常数,电极反应式的书写及电解质溶液中的离子平衡。
本题难度:困难