微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 碘钨灯比白炽灯使用寿命长。灯管内封存的少量碘与使用过程中沉积在管壁上的钨可以发生反应:W(s)+I2(g)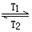 WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
WI2(g) ΔH<0(温度T1<T2)。下列说法正确的是
A.灯管工作时,扩散到灯丝附近高温区的WI2(g)会分解出W,W重新沉积到灯丝上
B.灯丝附近温度越高,WI2(g)的转化率越低
C.该反应的平衡常数表达式是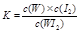
D.利用该反应原理可以提纯钨
2、计算题 (6分)在一定温度下,将2molA和2molB两种气体混合放入体积为2L的密闭刚性容器中,发生如下反应:3A(g)+B(g)  xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol?L-1。请回答:
xC(g)+2D(g) △H<0,2min末反应达到平衡,生成0.8molD,并测得C的浓度为0.4mol?L-1。请回答:
(1)x的值为_______
(2)A的转化率为α(A)%=______________
(3)此温度下该反应的平衡常数K=
3、填空题 反应aA(g)+bB(g) cC(g)(
cC(g)( H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:
H<0)在等容条件下进行。改变其他反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如下图所示:

回答问题:
(1)反应的化学方程式中,a:b:c为????????;
(2)A的平均反应速率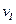 (A)、
(A)、 (A)、
(A)、 (A)从大到小排列次序为?????????;
(A)从大到小排列次序为?????????;
(3)B的平衡转化率 中最小的是?????,其值是???????;
中最小的是?????,其值是???????;
(4)由第一次平衡到第二次平衡,平衡移动的方向是????????????????,采取的措施是????????????????????????????;
(5)比较第II阶段反应温度(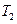 )和第III阶段反应速度(
)和第III阶段反应速度(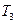 )的高低:
)的高低: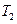 ??
??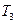
填“>、=、<”判断的理由是????????????????????????????????????????;
(6)达到第三次平衡后,将容器的体积扩大一倍,假定10min后达到新的平衡,请在下图中用曲线表示IV阶段体系中各物质的浓度随时间变化的趋势(曲线上必须标出A、B、C).
4、选择题 高温下,某反应达到平衡,平衡常数K= .已知恒容时升高温度,H2的浓度减小.下列说法正确的是( )
.已知恒容时升高温度,H2的浓度减小.下列说法正确的是( )
A.该反应的化学方程式为CO+H2O CO2+H2
CO2+H2
B.该反应的△H>0
C.升高温度,正反应速率增大,逆反应速率减小
D.恒温恒容下,增大压强,H2的浓度一定减小
5、实验题 为证明化学反应有一定的限度,进行如下探究活动:
I.取5mL 0.1mol/L的KI溶液,滴加5—6滴FeCl3稀溶液;
Ⅱ.继续加入2mL CCl4,盖好玻璃塞,振荡静置。
Ⅲ.取少量分液后得到的上层清液,滴加KSCN溶液。
Ⅳ.移取25.00mLFeCl3稀溶液至锥形瓶中,加入KSCN溶液用作指示剂,再用c mol/LKI标准溶液滴定,达到滴定终点。重复滴定三次,平均耗用c mol/LKI标准溶液VmL。
(1)探究活动I中发生反应的离子方程式为 。
请将探究活动Ⅱ中“振荡静置”后得到下层液体的操作补充完整:将分液漏斗放在铁架台上,静置。
。
(2)探究活动Ⅲ的意图是通过生成红色的溶液(假设溶质全部为Fe(SCN)3),验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈红色。对此同学们提出了下列两种猜想:
猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察。
为了验证猜想,查阅资料获得下列信息:
信息一:乙醚微溶于水,密度为0.71g/mL,Fe(SCN)3在乙醚中的溶解度比在水中大;
信息二:Fe3+可与[Fe(CN)6]4—反应生成暗蓝色沉淀,用K4[Fe(CN)6](亚铁氰化钾)溶液检验Fe3+的灵敏度比用KSCN溶液更高。
结合新信息,现设计以下实验方案验证猜想:
①请完成下表
实验操作
| 现象和结论
|
步骤一:
| 若产生暗蓝色沉淀,则 。
|
步骤二:
| 若乙醚层呈红色,则 。
②写出实验操作“步骤一”中的反应离子方程式: 。
(3)根据探究活动Ⅳ,FeCl3稀溶液物质的量浓度为 mol/L。
|