微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 COCl2俗称光气,是有毒气体。在一定条件下,可发生的化学反应为:COCl2(g) CO(g)+Cl2(g)
CO(g)+Cl2(g)
△H<0。下列有关说法正确的是 [???? ]
A.在一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率
B.当反应达平衡时,恒温恒压条件下通入Ar,能提高COCl2的转化率
C.单位时间内生成CO和Cl2的物质的量之比为1:1 时,反应达到平衡状态
D.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
参考答案:B
本题解析:
本题难度:一般
2、选择题 已知:CO(g) + H2O(g)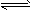 H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是
H2(g) + CO2(g)的平衡常数K随温度的变化如下表,下列说法正确的是
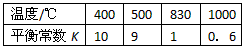 [???? ]
[???? ]
A.正反应是吸热反应
B.恒温时增大压强,正反应速率增大
C.830℃时,反应达到平衡,c(CO)=c(CO2)
D.400℃时,恒容反应器中投入CO、H2O、H2、CO2物质的量分别为5 mol、1 mol、2 mol、3mol,反应向逆方向进行
参考答案:B
本题解析:
本题难度:一般
3、填空题 据报道,在一定条件下,由CO2和H2合成乙醇已成为现实,该合成对解决能源问题具有重大意义。

(1)由CO2和H2合成乙醇的化学方程式为:

① 该反应的化学平衡常数的表达式为? K=?__________________
如果只是压强增大,则该反应的化学平衡常数K将________?(填“增大”或“减小”或“不变”)
②从上图可知,该平衡正向的△H________?0(填“>”或“<”或“=”)
(2)对于该化学平衡,为了提高H2的转化率,可采取的措施有__________
A.加压????B.升温????C.加催化剂????D.增加CO2的浓度
(3)已知25℃、101?kPa条件下,1g乙醇燃烧生成CO2和液态水时释放出a?kJ热量,请写出该条件下乙醇燃烧热的热化学反应方程式_____________________
(4)现有甲装置为原电池(a电极通氧气,b电极通乙醇),乙装置为电解池

①b电极上发生的电极反应式__________________
②若甲中有0.01mol?CH3CH2OH参加反应,则乙装置中生成的气体在标准状况下的体积共为_________L
参考答案:(1)①![]() 本题解析:
本题解析:
本题难度:一般
4、填空题 在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是??????(填写名称)
该反应450℃的平衡常数?????????500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是????????????????????
A.3V正(H2)=2V逆(NH3)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化
(3)如上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol计算从反应开始到平衡时,平均反应速率v(N2)为______________mol/(L?min)。
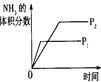
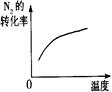
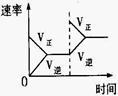
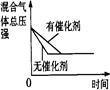
(4)下列研究目的和示意图相符的是???????????。
?
| A
| B
| C
| D
|
研究目的
| 压强对反应的影响(P1>P2)
| 温度对反应的影响
| 平衡体系增加N2对反应的影响
| 催化剂对反应的影响
|
图示
| 
| 
| 
| 
?
参考答案:(1)铁触媒,﹥
(2)B D
(3)0.01
本题解析:
试题分析:(1)该反应所用的催化剂是触媒,由于该反应是放热反应,升高温度平衡逆向移动,故?该反应450℃的平衡常数应该大于500℃时的平衡常数。
(2)由于容器中气体的平均分子量和容器中气体的密度如果没有平衡始终在发生着变化,故选BD。
(3)根据反应速率的计算公式可求得v(N2)为0.01mol/(L?min)。
(4)A.反应物气体的计量数大于生成物气体的计量数,则增大压强平衡向正反应方向移动,氨气的体积分数增大,压强越大反应速率越大,图象不符,故A错误;B.正反应放热,则升
本题难度:一般
5、选择题 将1?mol?H2(g)和2?mol?I2(g)置于某2?L密闭容器中,在一定温度下发生反应:H2(g)+I2(g)?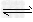 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是 2HI(g) ΔH<0,并达到平衡,HI的体积分数φ(HI)随时间变化的曲线如曲线Ⅱ所示.若改变反应条件,φ(HI)的变化曲线如曲线Ⅰ所示,则改变的条件可能是
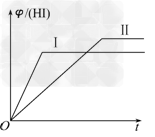 [???? ] [???? ]
A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒容条件下升高温度
D.恒温条件下,扩大反应容器体积
参考答案:C
本题解析:
本题难度:一般
|