微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 PH=3的盐酸和醋酸各100mL,分别和锌反应,反应完后,放出的气体一样多。若最后有一溶液中锌剩余,则下列判断正确的是 ( )
A.反应开始时速率v(HCl)> v(CH3COOH)
B.加入的锌质量相等
C.盐酸中锌有剩余
D.反应开始后不久,醋酸反应的速率小于盐酸
参考答案:C
本题解析:略
本题难度:一般
2、选择题 室温下,向10 mL 0.1 mol/L醋酸溶液中加水稀释后,下列说法正确的是(? )
A.溶液中粒子的数目减小
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中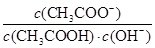 不变
不变
参考答案:D
本题解析:加水稀释醋酸的过程中,醋酸的电离程度增大,但溶液中c(H+)减小。由于KW不变,则c(OH-)增大,即溶液中OH-数目增多,选项A、C错误;再加入CH3COONa固体,c(CH3COO-)增大,能抑制CH3COOH的电离,B错误,溶液中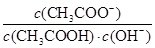 =
= 本题难度:一般
本题难度:一般
3、填空题 (8分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是??????????????????????????????(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)???????0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH???????7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
A.NH4HCO3;
B.NH4A;
C.(NH4)2SO4;
D.NH4Cl,按pH由大到小的顺序排列(填序号)。
参考答案:(共8分,每空2分)(1)A-+H2O 本题解析:
本题解析:
试题分析:(1)等物质的量的一元酸和一元碱恰好反应生成盐和水,生成的盐溶液呈碱性说明该酸是弱酸,生成的盐能水解导致溶液中氢氧根离子浓度大于氢离子浓度,溶液的pH值大于7,水解方程式为:A-+H2O HA+OH-;
HA+OH-;
(2)该盐含有弱根离子能促进水电离,氢氧化钠是强碱能抑制水电离,所以混合溶液中由水电离
本题难度:一般
4、填空题 (5分)常温下,将三种一元酸(HX、HY、HZ)分别和NaOH溶液等体积混合,实验数据如下:
酸
| c(一元酸) /mol·L
参考答案:
本题解析:
本题难度:一般
5、选择题 将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是[???? ]
A.c(H+)
B.Ka(HF)
C.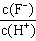
D.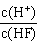
参考答案:D
本题解析:
本题难度:一般
|