微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 液氨与水相似,存在着微弱的电离:2NH3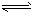 NH4++NH2-,- 50℃时,两种离子的平衡浓度均为
NH4++NH2-,- 50℃时,两种离子的平衡浓度均为
1×10-15 mol/L,下列有关液氨的离子积及其电离平衡的叙述中错误的是[???? ]
A.此温度下,液氨的离子积等于1×10 -30
B.在液氨中放入NaNH2,则液氨的离子积数值将增大
C.此温度下,在液氨中加入NaNH2,则液氨中c(NH4+)<1×10-15 mol/L
D.在液氨中加入NH4Cl,则液氨中c(NH4+)将大于c(NH2-)
参考答案:B
本题解析:
本题难度:一般
2、选择题 下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是( )
| 化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3
Ksp或Ka
Ksp=1.8×10-10
Ksp=2.0×10-12
Ka=1.8×10-5
Ka=3.0×10-8
Ka1=4.1×10-7
Ka2=5.6×10-11
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2+H2O═HCO3-+Cl-+HClO
C.向0.1mol?L-1 CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol?L-1的KCl和K2CrO4混合液中滴加1×10-3mol?L-1的AgNO3溶液,CrO42-先形成沉淀
参考答案:A.次氯酸根离子的水解程度大于醋酸根离子,所以c(CH3CO
本题解析:
本题难度:一般
3、选择题 (6分)(2012?广东)对于常温下pH为2的盐酸,传述正确的是( )
A.c(H+)=c(Cl
参考答案:
本题解析:
本题难度:一般
4、选择题 将0.1mol?L-1醋酸溶液加水稀释,下列说法正确的是( )
A.溶液中c(H+)和c(OH-)都减小
B.溶液中c(H+)增大
C.醋酸电离平衡向左移动
D.溶液的pH增大
参考答案:A、因醋酸溶液中加水稀释,溶液的体积增大,则电离产生的氢离子
本题解析:
本题难度:简单
5、选择题 在RNH2·H2O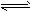 RNH3++OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是?[???? ] RNH3++OH-形成的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施是?[???? ]
A.通入HCl ?
B.加少量NaOH固体?
C.加水?
D.升温
参考答案:D
本题解析:
本题难度:一般
|