微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
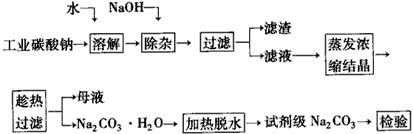
1、填空题 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示

|
回答下列问题
(1)滤渣的主要成分为_____________
(2)“趁热过滤”的原因是___________。
(3)若在实验室进行“趁热过滤”,可采取的措施是___________(写出一种)
(4)若“母液”循环使用,可能出现的问题及其原因是______________________。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
2、简答题 实验室制备纯碱的主要步骤是:①将配制好的饱和NaCl溶液倒入烧杯中加热,控制温
度在30--35℃,搅拌下分批加入研细的NH4HC03固体,②加料完毕后,继续保温30分钟,③静置、过滤得NaHC03晶体.④用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧,制得Na2C03固体.
四种盐在不回温度下的溶解度(g/l00g水)表

| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃ | 60℃ | 100℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
39.8
NH4HCO3
11.9
15.8
21.0
27.0
-①
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
16.4
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
55.3
77.3
①>35℃NH4HC03会有分解
请回答:
(1)反应温度控制在30-35℃,是因为______;为控制此温度范围,采取的加热方法为______.
(2)加料完毕后,继续保温30分钟,目的是______;静置后只析出NaHCO3品体的原因是______.
(3)洗涤NaHC03晶体的操作是______.
(4)过滤所得的母液中含有的溶质______(以化学式表示).
(5)写出本实验中制备纯碱的有关化学方程式______.
(6)测试纯碱产品中NaHC03含量的方法是:准确称取纯碱样品W?g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c?(mol/L)的HCl溶液滴定至溶液由红色到无色,所用HCl溶液体积为V1?mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HC1溶液总体积为V2mL,写出纯碱样品中NaHCO3质量分数的计算式:______.
3、填空题 纯碱(Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
①将饱和NaCl溶液倒入烧杯中加热,控制温度为30-35℃
②搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
③静置、过滤得NaHCO3晶体
④用少量蒸馏水洗涤、抽干
⑤将所得固体转入蒸发皿中灼烧得Na2CO3固体
问题:
(1)反应将温度需控制在30-35℃,通常采取的加热方法为_________________ ;控制该温度的原因是
__________________;
(2)静置后只析出NaHCO3晶体的原因是____________________。
【工业制备纯碱】

(3)沉淀池中反应的离子方程式为_________________________;
(4)循环(I)、 循环(Ⅱ)中物质的化学式分别为_____________________。两种制备纯碱的方法中,共同涉及的化学反应方程式为_________________________。
4、填空题 纯碱是一种重要的化工原料。目前制碱工业主要有“氨碱法”和“联合制 碱法”两种工艺。请按要求回答问题:
?(1)“氨碱法”产生大量CaCl2废弃物,请写出该工艺中产生CaCl2的化学方程式:_______________________________________________________;
(2)写出“联合制碱法”有关反应的化学方程式:____________________________________________;
(3) CO2是制碱工业的重要原料,“联合制碱法”与“氨碱法”中CO2的来源有何不同?__________________________________________________________;
(4)绿色化学的重要原则之一是提高反应的原子利用率。根据“联合制碱法”总反应,列出计算原子利用率的表达式:
原子利用率(%) =________________________________。
5、填空题 工业制纯碱时,第一步通过饱和食盐水、氨和二氧化碳反应,获得碳酸氢钠结晶。它的反应原理可以用下面的方程式表示:
NH3+CO2+H2O==NH4HCO3,NH4HCO3+NaCl(饱和)==NaHCO3↓+NH4Cl
以上反应的总结果是放热反应。下面设计了一个实验,用最简单的实验装置模拟实验这一过程,获得碳酸钠结晶。可供选择的实验用品有:稀盐酸、稀硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰,以及中学化学实验常用仪器。实验装置示意图(包括反应时容器中的物质)如下,图中玻璃容器旁自左至右分别用A、B、C······符号标明(请见题后说明)

(1)请写出在图上A、B、C······各玻璃容器中盛放物质的化学式或名称。 A:__________________,B:___________________,C:__________________, D:__________________,E_____________________。
(2)利用在本题所提供的实验用品,如何判断得到的产品是碳酸氢钠的结晶,而不是碳酸氢铵或食盐结晶?_______________________________
|