微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 著名化学家侯德榜改革国外的纯碱生产工艺,发明的新生产流程可简要表示如下:

(1)上述生产纯碱的方法称___,副产品的一种用途为___;
(2)沉淀池中发生的化学反应方程式是________;
(3)写出上述流程中X物质的分子式___;
(4)此流程能使原料氯化钠的利用率达到90%以上,主要是因为设计了循环____(填上述流程中的编号);
(5)从沉淀池中分离出沉淀的操作是___;
(6)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加____。
参考答案:(1)联合制碱法或侯德榜制碱法; 化肥或电解液等
(
本题解析:
本题难度:一般
2、填空题 技术的发展与创新永无止境。我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图所示
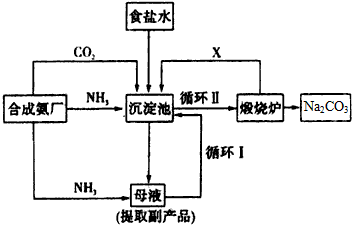
(1)向沉淀池中要通入CO2和氨气,应先通入________(填化学式),原因是_________________
(2)沉淀池中发生反应的化学方程式是____________________
(3)母液中的溶质主要是________,向母液中通氨气,加入细小食盐颗粒,冷却析出副产品。通氨气的作用是____________________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了____________(填上述流程中的编号)的循环;物质X是__________,从沉淀池中提取沉淀的操作是_______________
(5)写出煅烧炉中发生反应的化学方程式:____________________。
(6)这样制得的产品碳酸钠中可能含有的杂质是__________(填化学式),为检验该杂质的存在,具体操作是________________。
参考答案:(1)NH3;因为CO2在NaCl溶液中的溶解度较小,而NH
本题解析:
本题难度:一般
3、简答题 某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置的名称是:______.C装置中稀硫酸的作用为:______,使用球形干燥管的目的是:______.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
参照表中数据,请分析B装置中使用冰水是因为______.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在______装置之间(填写字母)连接一个盛有______的洗气装置,其作用是______.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______.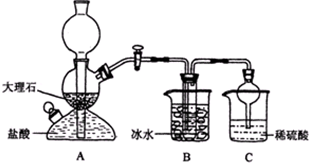
参考答案:(1)依据装置图分析,A为启普发生器,用来制取固体和液体不需
本题解析:
本题难度:一般
4、填空题 以食盐为原料进行生产并综合利用的某些过程如下图所示。
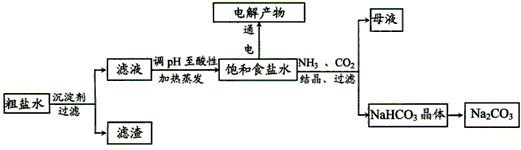
(1)除去粗盐中的Ca2+、Mg2+和SO42-离子,加入下列沉淀剂的顺序是(填序号)_________。
a.Na2CO3 b.NaOH c.BaCl2
(2)将滤液的pH调至酸性除去的离子是_________。
(3)电解饱和食盐水反应的离子方程式是_________。
(4)若向分离出NaHCO3晶体后的母液中加入过量生石灰,则可获得一种可以循环使用的物质,其化学式是_________。
(5)纯碱在生产生活中有广泛的应用。
① 纯碱可用于除灶台油污。其原因是(结合离子方程式表述)__________________。
② 常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13。则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是_________。
③ 工业上,可以用纯碱代替烧碱生产某些化工产品。如用饱和纯碱溶液与Cl2反应制取有效成分为NaClO的消毒液,其反应的离子方程式是__________________。(已知碳酸的酸性强于次氯酸)。
参考答案:(1)cab或者cba或者bca
(2)CO32-和
本题解析:
本题难度:一般
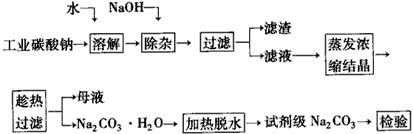
5、填空题 碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(钝度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示

|
|
回答下列问题
(1)滤渣的主要成分为_____________
(2)“趁热过滤”的原因是___________。
(3)若在实验室进行“趁热过滤”,可采取的措施是___________(写出一种)
(4)若“母液”循环使用,可能出现的问题及其原因是______________________。
(5)已知:
Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
参考答案:(1)Mg(OH)2、Fe(OH)3、CaCO3
(2
本题解析:
本题难度:一般