微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 我国化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:
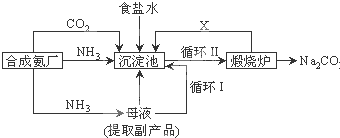
(1)上述生产纯碱的方法称______,副产品的一种用途为______.
(2)沉淀池中发生的化学反应方程式是______.
(3)写出上述流程中X物质的分子式______.
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了______(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是______.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加______.
2、填空题 工业生产纯碱的工艺流程示意图如下

完成下列填空:
(1)粗盐水加入沉淀剂A、B除杂质(沉淀剂A来源于石灰窑厂),写出A、B的化学式。
A_________B_________
(2)实验室提纯粗盐的实验操作依次为:取样、_________、沉淀、_________、_________、冷却结晶、_________、烘干。
(3)工业生产纯碱工艺流程中,碳酸化时产生的现象是__________________。碳酸化时没有析出碳酸钠晶体,其原因是__________________。
(4)碳酸化后过滤,滤液D最主要的成分是_________(填写化学式),检验这一成分的阴离子的具体方法是:__________________。
(5)氨碱法流程中氨是循环使用的,为此,滤液D加入石灰水产生氨。加石灰水后所发生的反应的离子方程式为:__________________滤液D加石灰水前先要加热,原因是__________________。
(6)产品纯碱中含有碳酸氢钠。如果用加热分解的方法测定纯碱中碳酸氢钠的质量分数,纯碱中碳酸氢钠的质量分数可表示为:__________________(注明你的表达式中所用的有关符号的含义)
3、填空题 【三选一化学与技术】
海水的综合利用,对于人类的生产生活有重要的意义。
(1)海水淡化沿海缺水地区获取淡水的方法之一,列举出海水淡化的两种方法_____________、________________。
(2)氯碱工业离子交换膜法生产中,透过离子交换膜的离子为_____________,氢氧化钠产生于____________(填‘“阳极”或“阴极”)。
(3)氯化钠为工业制纯碱的主要原料,制碱反应过程中法中析出NaHCO3的原因是______________;侯氏制碱法与索尔维制碱法相比除提高食盐利用率、无氯化钙生成的优势外还有______________?、_______________?从而综合利用原料、降低成本、减少环境污染。
4、简答题 某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及图1所示装置制取NaHCO3,反应的化学方程式为:
NH3+CO2+H2O+NaCl=NaHCO3+NH4Cl.然后再将NaHCO3制成Na2CO3.
(1)装置乙的作用是______.为防止污染空气,尾气中含有的______需要进行吸收处理.
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有______、洗涤、灼烧.
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1min的NaHCO3样品的组成进行了研究.取加热了t1min的NaHCO3样品29.6g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中有关离子的物质的量的变化如图2所示.则曲线c对应的溶液中的离子是______(填离子符号);该样品中NaHCO3和Na2CO3的物质的量之比是______.
(4)若取10.5gNaHCO3固体,加热了t1min后,剩余固体的质量为7.4g.如果把此剩余固体全部加入到200mL1mol/L的盐酸中,则充分反应后溶液中H+的物质的量浓度为______(设溶液体积变化忽略不计).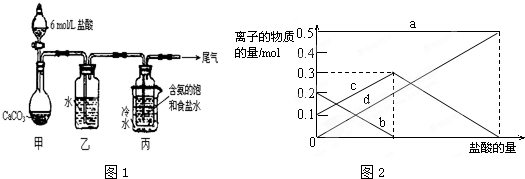
5、简答题 某校学生在实验室中设计了如下装置,模拟侯德榜制碱法,获得碳酸氢钠晶体,反应原理可用如下化学方程式表示:NH3+CO2+NaCl+H2O═NH4Cl+NaHCO3↓,依据此原理,再将碳酸氢钠晶体加热分解而制得碳酸钠晶体,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和:
(1)A装置的名称是:______.C装置中稀硫酸的作用为:______,使用球形干燥管的目的是:______.
(2)下表中所列出的是相关物质在不同温度下的溶解度数据(g/100g水)
| 0℃ | 10℃ | 20℃ | 30℃ | 40℃ | 50℃
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
NaHCO3
6.9
8.1
9.6
11.1
12.7
14.5
NH4Cl
29.4
33.3
37.2
41.4
45.8
50.4
参照表中数据,请分析B装置中使用冰水是因为______.
(3)该校学生在检查完此套装置气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在______装置之间(填写字母)连接一个盛有______的洗气装置,其作用是______.
(4)若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.04g,则NaHCO3的产率为______.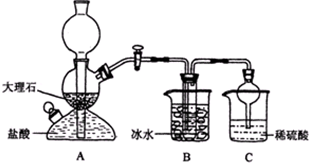
|