微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述正确的是
A.将pH=2的盐酸和pH=2的醋酸等体积混合,混合后溶液的pH=2
B.HA-比HB-更难电离,则NaHA溶液的pH一定比NaHB溶液的大
C.在饱和氨水中加入同浓度的氨水,平衡正向移动
D.某温度下,Ba(OH)2溶液中,Kw=10-12,pH=8的该溶液中加入等体积pH=4的盐酸,混合溶液的pH=7
参考答案:A
本题解析:
试题分析:A、两种溶液等体积混合后醋酸分子和醋酸根的浓度都下降为原来的一半,但两者的比值不变,混合后氢离子浓度也不变,所以QC等于Ka,平衡不移动,混合后溶液的pH等于2,正确;B、若NaHA溶液和NaHB溶液都是碱性溶液,则需要考虑H2A和H2B的酸性才能确定溶液pH的关系,错误;C、平衡不移动,错误;D、恰好中和得到中性溶液,pH= 6,错误。
本题难度:一般
2、选择题 物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9。下列有关说法正确的是(???)
A.HX、HY、HZ三种酸的酸性由强到弱的顺序为HZ>H Y>HX
B.HX是强酸,HY、HZ是弱酸,且HY的酸性强于HZ
C.X-、Y-、Z-三种酸根离子均能水解,且水解程度Z->Y->X-
D.三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-)
参考答案:BD
本题解析:
试题分析:物质的量浓度相同的三种盐NaX、NaY、NaZ溶液,其pH依次为7、8、9,根据无弱不水解,有弱就水解,越弱越水解的原则,可以知道HX、HY、HZ三种酸的酸性由强到弱的顺序为HX>HY>HZ,故A错误;NaX的pH为7,所以HX是强酸,HY、HZ是弱酸,所以B正确;X-不能水解,所以C错误;水解程度为Z->Y-,而X-不能水解,所以三种盐溶液中X-、Y-、Z-的浓度大小顺序为c(X-)>c(Y-)>c(Z-),故D正确,所以本题的答案选择BD。
点评:本题考查了盐类的水解,该考点是
本题难度:简单
3、选择题 某溶液中在25℃时由水电离出的氢离子浓度为1×10-12 mol/L,下列说法正确 的是(???????)
的是(???????)
A.HCO3-离子在该溶液中一定不能大量共存
B.该溶液的pH一定是12
C.向该溶液中加入铝片后,一定能生成氢气
D.若该溶液的溶质只有一种,它一定是酸或碱
参考答案:A
本题解析:略
本题难度:一般
4、选择题 某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的pH变化曲线如图所示。下列判断正确的是

A.a、c两点溶液的导电能力相同
B.a、b、c三点溶液水的电离程度a>b>c
C.b点溶液中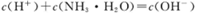
D.用等浓度NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液体积Vb =Vc。
参考答案:B
本题解析:
试题分析:盐酸溶液中的氢离子主要是盐酸电离出来的,盐酸完全电离,而NH4Cl溶液中的氢离子是水电离产生的。体积和pH都相同的盐酸和氯化铵溶液加水稀释的过程中,盐酸不能继续电离,盐酸溶液中氢离子浓度变化大;水解是微弱的,氯化铵溶液中铵离子可继续水解,溶液中的氢离子浓度变化小,所以含c点的曲线pH变化是盐酸溶液的,含a、b点的曲线pH变化是氯化铵溶液的. A、溶液的导电能力和溶液中自由移动离子的多少有关,当溶液的体积相等时,a、c两点溶液的离子浓度不一样,所以导电能力不一样,故A错误; C、b点溶液中
本题难度:一般
5、选择题 99℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH=2,下列叙述中不正确的是( )
A.此时水的离子积KW=1×10-14
B.水电离出的c(H+)=1×10-10mol·L-1
C.水的电离程度随温度升高而增大
D.c(Na+)=c(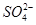 )
)
参考答案:A
本题解析:
试题分析:99℃时,蒸馏水的pH=6,说明Kw=1×10-12,因此温度升高水的电离程度增大。NaHSO4=Na++H++SO42-,pH=2,说明c(H+)=0.01mol/L,且都是NaHSO4电离的,所以水电离出的c(H+)=1×10-10mol·L-1。所以不正确的是A。
点评:水电离出的c(H+)和溶液中的c(H+)不同,如果溶液中的H+是酸电离的,则溶液中的OH-是水电离的,由此可以求出水电离出的c(H+)。
本题难度:一般